
Pengecualian Aturan Oktet (Oktet Berkembang) pada Ikatan Kimia YouTube
1. Ikatan Kovalen Rangkap Dua. Ikatan ini dibentuk oleh atom-atom nonlogam yang menyumbangkan dua elektron tidak berpasangan untuk berikatan sehingga memenuhi kaidah. Berikut ini beberapa contoh yang memliki kovalen berangkap dua: a. Struktur Lewis Molekul O2. Dalam atom O terdapat dua elektron yang tidak berpasangan.

ATURAN OKTET DAN IKATAN ION OLEH HASNAWATI SMKN 1 MUARA BADAK YouTube
Contoh senyawa yang memenuhi aturan oktet adalah SiF 4. Atom Si memiliki elektron valensi 4. Untuk mencapai kestabilan, atom Si memerlukan 4 elektron lagi. Atom F memiliki elektron valensi 7, untuk stabil F memerlukan 1 elektron. Dengan saling memasangkan 1 elekton maka senyawa SiF 4 membentuk ikatan kovalen yang memenuhi kaidah oktet. Struktur.

Aturan Oktet YouTube
Ini adalah definisi aturan oktet dalam kimia dan ringkasan singkat tentang sejarah di baliknya. Menu. Rumah. Sains, Teknologi, Matematika Sains matematika Ilmu Sosial. Istilah Kimia Definisi Aturan Oktet. Ini adalah struktur Lewis karbon dioksida, yang menggambarkan aturan oktet.

Ikatan Kimia Kelas 10 • Part 3 Ikatan Kovalen, Struktur Lewis, Aturan Oktet YouTube
KOMPAS.com - Aturan oktet adalah suatu kaidah sederhana dalam kimia yang menyatakan bahwa atom dari kelompok unsur utama cenderung berikatan dengan atom lain.. Aturan oktet sangat berguna untuk memprediksi rumus kimia senyawa biner sederhana. Aturan oktet dapat diterapkan pada unsur-unsur golongan utama.

Aturan Oktet PDF
Tetapi ada beberapa senyawa yang mengalami penyimpangan oktet, diantaranya adalah sebagai berikut. 1. Senyawa yang tidak mencapai oktet (∑e<8) Senyawa yang atom pusatnya memiliki jumlah elektron valensi <4, seperti Be, B, dan Al, menyebabkan terbentuknya ikatan kimia yang belum mencapai oktet. Hal tersebut dinamakan oktet tak lengkap. Contoh.

Aturan Oktet dan Penyimpangan atau Kegagalan Aturan Oktet YouTube
Kaidah oktet adalah aturan yang menyatakan bahwa atom-atom paling stabil ketika kulit terluarnya (kulit valensi) memiliki delapan elektron. Itu artinya, atom-atom yang memiliki elektron kurang dari delapan pada kulit terluarnya akan cenderung membentuk ikatan dengan atom-atom yang lain untuk mencapai kaidah oktet.
Senyawa berikut yang memenuhi aturan oktet adalah
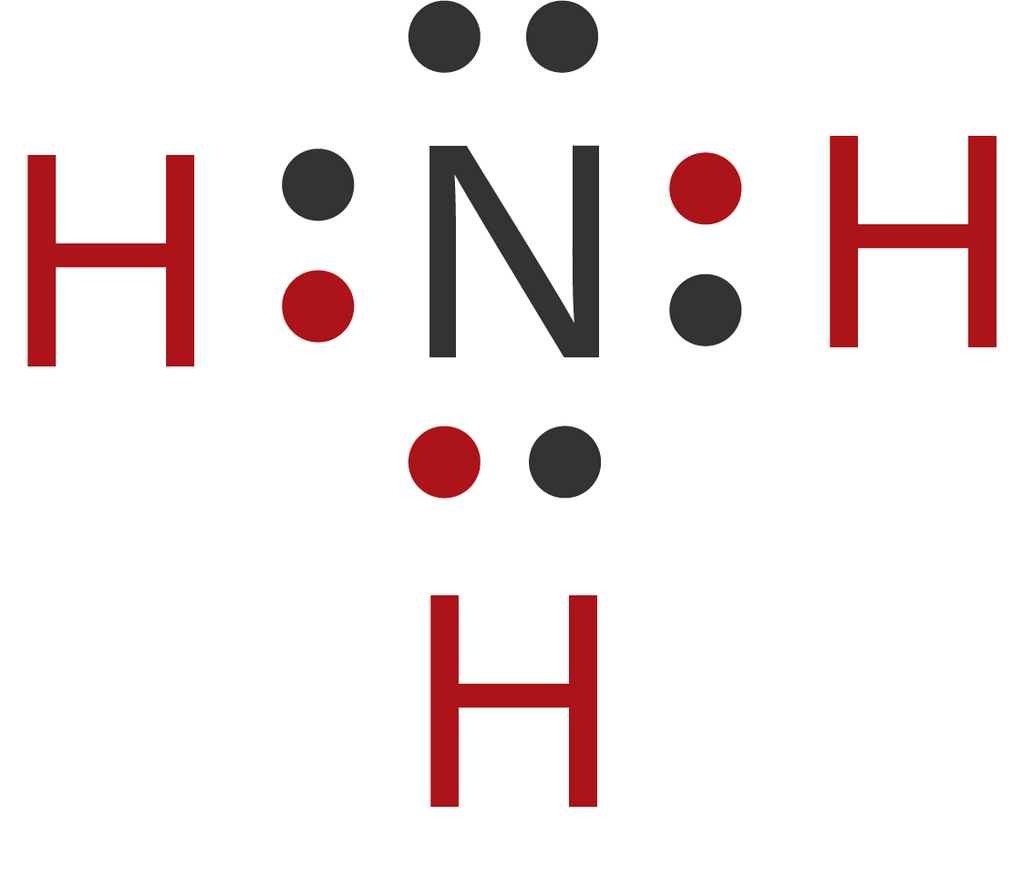
Karena pada ikatan kimia yang berinteraksi adalah elektron valensi, maka kita akan pahami terlebih dahulu mengenai simbol lewis serta aturan duplet dan oktet di bawah ini.Jika kamu sudah paham kamu bisa langsung ke jenis-jenis ikatan kimia ya! [inline_ads] B. Simbol Lewis, Aturan Oktet, dan Aturan Duplet

Aturan Duplet Dan Oktet PDF
Pengecualian untuk Aturan Oktet. Diperbarui pada 03 Agustus 2019. Aturan oktet adalah teori ikatan yang digunakan untuk memprediksi struktur molekul molekul yang terikat secara kovalen. Menurut aturan, atom berusaha untuk memiliki delapan elektron di kulit terluarnya—atau valensi—elektron. Setiap atom akan berbagi, mendapatkan, atau.

Kimia kelas 10 Penyimpangan aturan oktet dan ikatan koordinasi YouTube
Gas mulia yang memiliki susunan elektron valensi tidak sesuai aturan oktet adalah… Jawaban: Ada enam unsur dalam golongan gas mulia, yaitu helium (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe), dan radon (Rn). Untuk mengetahui apakah unsur-unsur tersebut memenuhi aturan oktet, kita harus menentukan konfigurasi elektronnya: [He]: 2 [Ne.

Aturan Oktet atau Kaidah Oktet Kimia Beserta Contohnya Belajar IPA
Pembahasan. Aturan oktet menyatakan bahwa atom-atom cenderung bergabung bersama sedemikiannya sehingga tiap-tiap atom memiliki 8 elektron valensi. Option A salah, CO = 2 4 ; = 2 6. Elektron valensi C = 6 (tidak memenuhi aturan oktet) Option B salah, = 2 5 ; = 2 6. Elektron valensi N =10 (tidak memenuhi aturan oktet) Option C salah, = 2 3 ; = 2 7.

IKATAN KIMIA Kestabilan Unsur & Aturan Oktet YouTube
Aturan oktet dapat diterapkan pada unsur-unsur golongan utama, seperti karbon, nitrogen, oksigen, dan halogen. Aturan ini juga dapat diterapkan pada unsur logam seperti natrium dan magnesium. Suatu unsur dapat mencapai kestabilan dengan beberapa cara, yaitu melepaskan elektron dan menerima atau menangkap elektron.

Bentuk Molekul Dari Senyawa Yang Terjadi Jika Kedua Unsur Tersebut Berikatan Sesuai Aturan Oktet
Senyawa yang melampaui aturan oktet adalah salah satu dari tiga jenis penyimpangan dari aturan oktet. Senyawa yang melampaui aturan oktet adalah senyawa yang memiliki lebih dari satu oktet elektron dalam valensinya. Senyawa yang melampaui aturan oktet disebut juga sebagai senyawa hipervalen atau kelebihan valensi. Baca juga: Teori Kulit.

IKATAN KIMIA Aturan Duplet Aturan Oktet Proses Kestabilan Unsur YouTube
Kegagalan aturan oktet dapat terjadi umumnya pada unsur-unsur transisi karena mereka tidak dapat memenuhi aturan oktet. Aturan oktet gagal meramalkan rumus kimia senyawa dari unsur transisi maupun postransisi. Unsur transisi adalah kelompok unsur kimia yang berada pada golongan 3 sampai 12 (IB sampai VIIIB pada sistem lama) pada tabel periodik.

Perhatikan gambar struktur Lewis beberapa senyawa berikut...
Pengertian pengecualian aturan oktet adalah penyimpangan dari kaidah (tidak mengikuti kaidah) oktet (8 elektron valensi), tetapi dibenarkan. Pengertian ikatan kovalen raksasa adalah ikatan kovalen yang menyusun struktur molekul berbentuk jaringan pada fase padat sehingga terbentuk molekul berukuran besar yang tersusun dalam unit sel tertentu.

Penjelasan Pengecualian Aturan Oktet Dan Ikatan Ion PDF PDF
Pembahasan struktur Lewis berkaitan erat dengan aturan oktet dan duplet. Aturan oktet adalah aturan yang menyatakan bahwa keseimbangan atom akan tercapai jika jumlah elektron valensinya sudah mencapai delapan elektron. Sementara itu, aturan duplet adalah aturan yang menyatakan bahwa keseimbangan atom akan tercapai jika jumlah elektron.

IKATAN KIMIA PENGECUALIAN DAN KEGAGALAN ATURAN OKTET ( KIMIA SMA KELAS 10 ) YouTube
Pengertian Aturan Oktet. Aturan oktet adalah aturan yang menyatakan bahwa atom dari kelompok unsur utama cenderung berikatan dengan atom lain dengan cara memberi ataupun menerima elektron sedemikian rupa sehingga atom yang berikatan memiliki delapan elektron di kulit terluarnya. Sehingga konfigurasi elektron yang didapat akan sama dengan gas.