
Bilangan Oksidasi S Yang Terkecil Terdapat Dalam Lengkap
Namun, jika bilangan oksidasinya menurun dari sebelum reaksi hingga setelah reaksi maka spesies tersebut dikatakan mengalami reduksi. Bilangan oksidasi juga berguna dalam penyetaraan persamaan reaksi kimia redoks. Tujuannya yaitu memastikan jumlah total elektron yang hilang dalam oksidasi sama jumlahnya dengan elektron yang diperoleh melalui.

Bilangan Oksidasi Mn Berubah Dari
Berdasarkan konsep perubahan bilangan oksidasi,. Jadi, unsur H mengalami kenaikan biloks dari 0 ke +1, sehingga mengalami reaksi oksidasi. H2 ——> H2O (reaksi oksidasi) Paham ya dengan penentuan reaksi redoks berdasarkan bilangan oksidasi. Dalam hal ini, kamu memang perlu paham betul dengan aturan-aturan penentuan bilangan oksidasi.

Jelaskan Konsep Reaksi Oksidasi Dan Reduksi Menurut Perubahan Bilangan Oksidasi Tulisan
Mn mengalami perubahan biloks dari +4 menjadi +2 dan Cl mengalami perubahan biloks dari -1 menjadi 0. Persamaan reaksi redoks soal di atas dapat dituliskan seperti di bawah ini. MnO2 +2NaCl+2H2SO4 → MnSO4 +Na2SO4 +2H2O +Cl2. Dari persamaan reaksi redoks tersebut, yang mengalami perubahan bilangan oksidasi adalah atom Mn dan Cl.

Bilangan oksidasi Mn tertinggi terdapat pada senyawa....
Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.

Reaksi berikut yang mengubah bilangan oksidasi Mn dari +7...
Berdasarkan reaksi di atas, biloks unsur Mn mengalami perubahan dari +6 menjadi +7 dan +4. Reaksi ini merupakan reaksi redoks spesial/autoredoks, yaitu reaksi disproporsionasi dimana reduktor dan oksidatornya adalah senyawa yang sama.. Unsur klorin dalam senyawa dapat ditemukan dengan bilangan oksidasi dari -1 hingga +7. Diantara ion-ion ClO.

Jelaskan Konsep Reaksi Oksidasi Dan Reduksi Menurut Perubahan Bilangan Oksidasi Tulisan
Bilangan Oksidasi : Bilangan Oksidasi besi ( F e Fe ) berubah dari +3 menjadi O. Bilangan oksidasi timbal ( S n Sn ) berubah dari -2 menjadi +4. Baca juga: Hukum-Hukum Dasar Kimia. Sobat Pijar, semoga pemahaman tentang perubahan oksidasi dan reduksi membawa kita lebih dekat pada kekayaan interaksi molekuler yang membangun segala.

Aturan Penentuan Bilangan Oksidasi Materi Reaksi Redoks Kimia SMA Pojan.id YouTube
1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya. 5.

Cara Menentukan Bilangan Oksidasi Matob
Aturan Penentuan Bilangan Oksidasi. Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah: Unsur Bebas → Biloks = 0. Contoh: Na, K, Cl 2, M 2, dan O 2. Logam yang Berikatan dengan Unsur Lain → Biloks = Positif. Contoh: Gol I: Na, K, Rb → biloks = +1

Jelaskan Konsep Reaksi Oksidasi Dan Reduksi Menurut Perubahan Bilangan Oksidasi Tulisan
Halo coffee Friends kali ini kita di sajikan sebuah reaksi redoks kemudian ditanyakan berapakah bilangan oksidasi MN itu mengalami perubahan dari berapa menjadi berapa maka yang kita lihat adalah mno2 dengan mncl2 kita akan membuat aturan biloks yaitu aturan biloks adalah untuk mno2 mno2 kita akan menggunakan aturan biloks ketiga dan aturan biloks ke-7 di mana bilangan oksidasi MN ditambah 2.

Cara Menentukan Bilangan Oksidasi dan Contohnya
Jumlah bilangan oksidasi dari unsur - unsur dalam suatu senyawa adalah 0. Contoh dalam senyawa H 2 O,. Setarakan jumlah atom pada spesi yang akan mengalami perubahan biloks; Jika suasana asam, tambahkan molekul H 2 O pada sisi yang kekurangan atom O;. MnO 4 - + 8H + + 5e Mn 2+ + 4H 2 O (x2) 2Cl - Cl 2 + 2e.
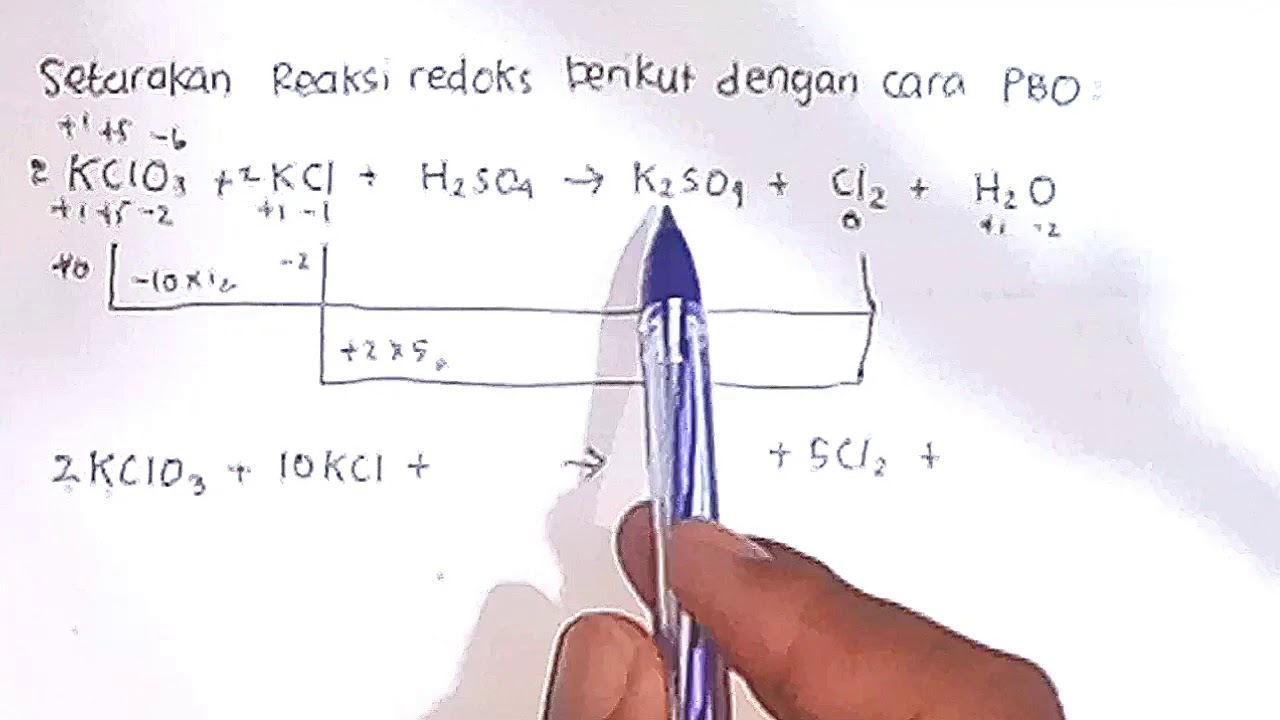
Cara Perubahan Bilangan Oksidasi Coretan
Perubahan bilangan oksidasi disebabkan adanya transfer elektron.. Jika bilangan oksidasi mengalami kenaikan, maka telah terjadi reaksi oksidasi. Sebaliknya, jika bilangan ini mengalami penurunan, maka telah terjadi reaksi reduksi.. Jadi, bilangan oksidasi unsur K, Mn, dan O dalam KMnO4 adalah +1, +7, dan -2.

Cara Menentukan Bilangan Oksidasi yang Mudah, Berikut Penjelasannya
Misalnya biloangan oksidasi Mn pada senyawa MnO 2 berbeda dengan Mn pada MnO.. Berdasarkan Perubahan Bilangan Oksidasi.. Biloks Fe = 6/2 = +3. Jadi, yang merupakan reaksi oksidasi adalah FeO (biloks Fe mengalami kenaikan dari +2 menjadi +3) Dan yang mengalami reaksi reduksi adalah O 2 (biloks O menurun dari 0 menjadi -2).

Cara mudah menentukan bilangan oksidasi dalam senyawa kimia YouTube
Unsur yang mengalami perubahan bilangan oksidasi adalah Mn, yaitu dari +7 menjadi +2 dan Cl yaitu dari -1 menjadi 0. 2. Memberi koefisien yang sesuai pada unsur-unsur yang mengalami perubahan bilangan oksidasi. Atom Mn sudah setara. Atom Cl belum setara, di ruas kanan terdapat 2 atom Cl sedangkan di sebelah kiri hanya terdapat satu atom Cl.

Bilangan Oksidasi Mn Tertinggi Terdapat Dalam Senyawa Judul Soal
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

Cara Perubahan Bilangan Oksidasi Coretan
Oksidator adalah zat yang mengalami penurunan bilangan oksidasi. Reduktor adalah zat yang mengalami kenaikan bilangan oksidasi. Lebih mudahnya, perhatikan contoh soal reaksi redoks berdasarkan bilangan oksidasi berikut ini: Tentukan apakah reaksi berikut termasuk ke dalam reaksi redoks atau bukan redoks! Jika iya, tentukan oksidator, reduktor.

Bilangan Oksidasi Atom Mn YouTube
Oksidasi adalah ketika suatu zat mengalami arus listrik, maka akan terjadi pelepasan elektron (), sehingga jumlah bilangan oksidasi (biloks)-nya akan naik. Bilangan Oksidasi (Biloks) Nah, hal lain yang perlu elo tau saat mempelajari materi reaksi redoks adalah bilangan oksidasi atau biloks. Biloks itu apaan, sih? "Bilangan oksidasi adalah.