
Contoh Soal Laju Reaksi Sma Contoh Terbaru
Dibaca Normal 4 menit. Berikut ini rangkuman materi tentang konsep laju reaksi rumus dan contoh soalnya. tirto.id - Laju reaksi adalah laju berkurangnya kosentrasi pereaksi atau laju bertambahnya konsentrasi hasil reaksi tiap satuan waktu. Secara sederhana, laju reaksi diartikan sebagai perubahan konsentrasi pereaksi (reaktan) atau reaksi.

CARA MENCARI ORDE REAKSI DAN PERSAMAAN LAJU REAKSI JIKA DATA PERCOBAAN TIDAK ADA YANG SAMA !!
Semakin cepat reaksi berlangsung, maka harga tetapan laju reaksi semakin besar. Dan berbanding lurus dengan perubahan suhu. Semakin tinggi suhu reaksi, semakin besar harga tetapan laju reaksinya. Cara menentukan tetapan laju reaksi dapat dilakukan setelah diketahui orde reaksi. Untuk lebih mudahnya perhatikan contoh soal berikut.

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI JIKA DATA ADA YANG TIDAK SAMA YouTube
Bagaimana cara mencari laju reaksi jika diketahui waktu? Untuk menjawab pertanyaan tersebut. Terlebih dulu kita perhatikan contoh soal laju reaksi berikut. Dari reaksi H2 dan NO diperoleh data sebagai berikut. [H2]awal (M) [NO]awal (M) Waktu (detik) 0,1 0,1 80 0,2 0,1 40 0,2 0,2 10 Tentukan persamaan laju reaksi! Pembahasan: Hal yang harus kita lakukan

Cara mudah mencari laju reaksi soal persen yang bereaksi kimia SMA YouTube
Untuk cara memahami profil diagram energi aktivasi yang dikaitkan dengan laju reaksi dapat dibaca di sini. Berikut ini beberapa grafik yang paling sering digunakan pada soal-soal ujian nasional maupun ujian lain. Ketika satu pereaksi, misal [A] diubah konsentrasinya maka laju reaksi juga berubah berbanding lurus terhadap perubahan konsentrasi.

Laju Reaksi Kimia Kelas 11 • Part 5 Persamaan Laju Reaksi dan Orde Reaksi YouTube
Laju reaksi adalah perubahan konsentrasi reaktan atau produk per satuan waktu. Besaran laju reaksi dilihat dari ukuran cepat lambatnya suatu reaksi kimia. Laju reaksi mempunyai satuan M/s (Molar per detik ). [1] Laju reaksi dilambangkan dengan v atau r. Laju reaksi atau kecepatan reaksi menyatakan bahwa banyaknya reaksi kimia yang berlangsung.

Persamaan laju reaksi orde reaksi Kimia SMA YouTube
Pengertian Laju Reaksi. Laju reaksi adalah perubahan konsentrasi dari reaktan ataupun produk per satu satuan waktu. Untuk reaksi dengan reaktan A dan B menghasilkan produk C dan D seperti pada rumus persamaan reaksi berikut, seiring waktu jumlah molekul reaktan A dan B akan berkurang dan jumlah molekul produk C dan D akan bertambah, dan rumus laju reaksi (v) yaitu:

contoh soal laju reaksi kimia dan pembahasannya Perhitungan kimia
Rumus dan cara mudah menentukan laju pembentukan dan laju penguraian jika diketahui mol awal dan mol pada saat setimbang serta volume . kimia sma.

Pengertian dan Teori Laju Reaksi Materi Kimia Kelas 11
Maka diperoleh bahwa orde reaksi Natrium monoksida (NO) adalah 2 dan orde reaksi bromin (Br2) adalah 1. Tentukan tetapan persamaan laju reaksi Nitrosil bromida (NOBr2) menggunakan data percobaan yang pertama: Jadi, kecepatan laju reaksi pembentukan Bromin adalah sebesar 6 molar per detik. Hal ini berarti pada reaksi antara Natrium monoksida dan.

Belajar Kimia Materi dan Contoh Soal Laju Reaksi Part 2 YouTube
Laju reaksi mengacu pada kecepatan di mana reaktan bergabung dan membentuk produk, atau laju pembentukan produk dari reaktan. Berbagai faktor akan memengaruhi laju reaksi, seperti suhu, tekanan, keadaan zat, konsentrasi, dan katalis. Dengan pengetahuan tentang hukum laju reaksi dan bagaimana berbagai faktor dapat mempengaruhinya, kamu akan.

Cara Cepat menentukan Laju Reaksi Konsep Dasar tabel MTS YouTube
Faktor yang Memengaruhi Laju Reaksi. Laju reaksi bisa dipengaruhi oleh beberapa faktor, lho! Faktor-faktor tersebut dapat mempercepat laju reaksi atau malah memperlambat laju reaksi. Faktor-faktor tersebut antara lain suhu, konsentrasi, katalisator, dan luas permukaan sentuh. Nah, kita akan bahas beberapa saja, ya.
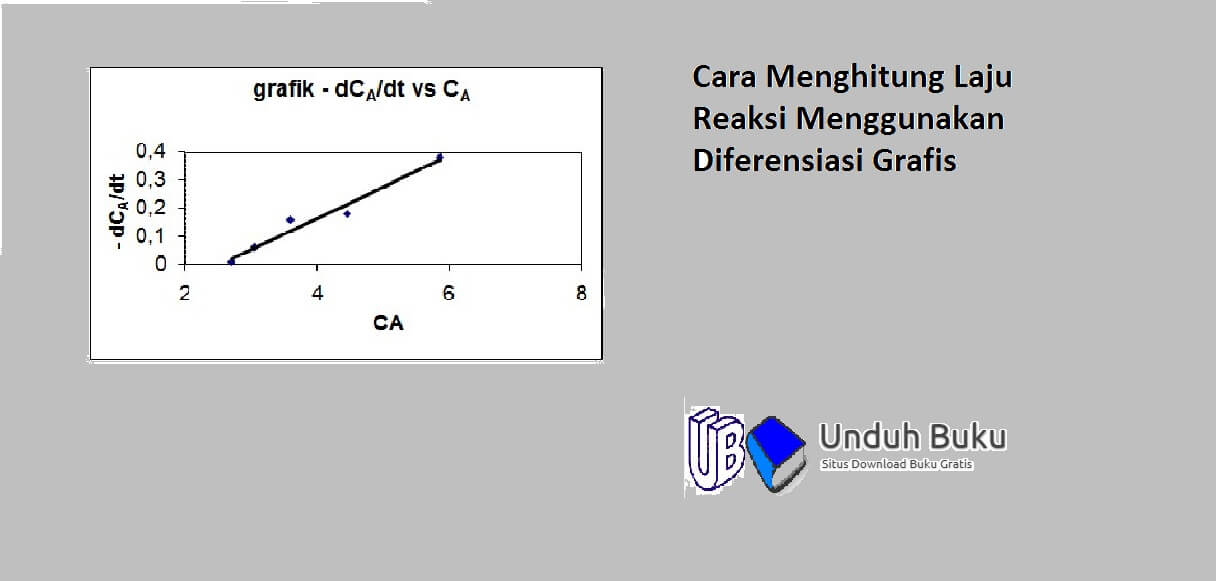
Cara Menghitung Laju Reaksi Menggunakan Diferensiasi Grafis
c. r O2 = - ½ x r SO3 = - ½ x 0,0125 = - 0,00625 M/s. Jadi, laju berkurangnya O2 sebesar - 6,25 x 10-3 M/s. Itulah ulasan tentang Laju Reaksi : Pengertian, Faktor Yang Mempengaruhi, Dan Rumus Beserta Contoh Soalnya Lengkap Semoga apa yang diulas diatas bermanfaat bagi pembaca. Sekian dan terimakasih. Baca juga refrensi artikel.

Persamaan Laju Reaksi dan grafik orde Konsep Mudah YouTube
Oleh karena itu persamaan dari materi ini adalah sebagai berikut. Di mana, v= laju reaksi (mol/L/s); = perubahan mol; = perubahan waktu. Di mana, v= Laju reaksi (mol/L/s) ; k= konstanta laju reaksi; n= orde reaksi zat B; m= orde reaksi zat A. Secara logika, pada saat bereaksi, zat reaktan pasti makin berkurang, dan zat produk pasti bertambah bukan?

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI JIKA DATA YANG DIKETAHUI WAKTU YouTube
Semangat pagi.Di Vidio ini, kita akan belajar cara mudah menentukan persamaan laju reaksi dan orde reaksi.jadi, untuk menentukan persamaan laju reaksi dan.

Laju Reaksi Pembentukan Gas Hidrogen YouTube
Menentukan Persamaan Laju Reaksi. Persamaan laju suatu reaksi tidak memiliki hubungan dengan stoikiometri reaksi, tetapi ditentukan melalui percobaan, salah satu metode yang sering digunakan adalah metode laju awal. Menurut cara ini, laju diukur pada awal reaksi dengan konsentrasi yang berbeda-beda. Sebagai contoh pada reaksi antara HCl dan.

Laju Reaksi [Hubungan Konsentrasi Reaktan dan Waktu] CEK DESKRIPSI YouTube
Istilah ini lebih dikenal sebagai laju reaksi. Bagaimana cara mencari laju reaksi itu? Pada artikel ini, Quipper Blog akan membahas beberapa contoh soal terkait laju reaksi. Yuk, simak selengkapnya! Contoh Soal 1. Sebanyak 22,2 gram CaCl2 dilarutkan ke dalam 4 liter air. Molaritas CaCl2 tersebut adalah.. (Ar Ca = 40, Ar Cl = 35,5) 0,05 M;

Orde reaksi total laju reaksikimia SMA YouTube
Latihan Soal Pendahuluan Laju Reaksi (Sedang) Pertanyaan ke 1 dari 5. Apabila kita memiliki reaksi A+B → → C didapatkan laju reaksinya sebesar 5 { [}satuan {]}, maka artinya.. 1. Terjadi perubahan konsentrasi total sebanyak 5 { [}satuan {]} 2. Terjadi penambahan A dan B sebanyak 5 { [}satuan {]}