
Cara Menghitung Normalitas Naoh Satu Manfaat
Namun, posisi gugus -OH berbeda. Pada 1-butanol, gugus-OH terikat dengan atom C nomor 4. Sementara itu, pada 2-butanol, atom -OH terikat dengan atom C nomor 2. Isomer gugus fungsi.. Bagaimana Cara Menghitung Isomer Alkana? Untuk menentukan isomer alkana, kamu bisa menggunakan cara berikut. Untuk 2 atom C tidak memiliki isomer.

Cara mencari chord lagu YouTube
Contoh soal: 2905 ml * (1 L / 1000 ml) = 2,905 L. 4. Bagilah jumlah mol dengan banyaknya liter. Karena kamu sudah mengetahui banyaknya liter, kamu dapat membagi jumlah mol terlarut dengan banyaknya liter untuk mencari molaritas larutan. Contoh soal: molaritas = mol terlarut / liter larutan = 1,2 mol CaCl 2 / 2,905 L = 0,413080895.

Cara Menghitung Jumlah Atom Dalam Rumus Kimia Gini Caranya Hot My XXX Hot Girl
Dengan begitu, kita bisa memperoleh rumus derajat ionisasi dari pengertian di atas sebagai berikut: Derajat ini digunakan untuk mewakili kekuatan suatu asam/basa. Elektrolit kuat akan memiliki derajat ionisasi sempurna, yaitu α=1. Kalau dalam persen berarti 100%. Elektrolit lemah akan memiliki derajat ionisasi 0<α<1, atau α=0,5.

14+ Contoh Soal Reaksi Ionisasi Asam Basa Contoh Soal Terbaru
Tips cepat cara konversi pH ke [H⁺] atau [OH⁻] dan sebaliknya. Dalam pokok bahasan larutan asam basa di pelajaran kimia SMA/MA/SMK kerap ditemui soal-soal perhitungan [H +], [OH -], pH, dan pOH.Dalam soal bentuk pilihan ganda (multiple choice) nilai pH sering dinyatakan sebagai persamaan yang terdiri dari bilangan dan logaritma (log), misalnya 5 - log 2 atau 9 + log 2.

Contoh Soal Fraksi Mol Dan Pembahasannya
Untuk mencari tetapan ionisasi dari senyawa hidroksilamin tersebut, kita bisa menggunakan rumus yang telah kita buat sebelumnya yaitu : Kb = ( Konsentrasi ion OH- )⋀2 / Konsentrasi Basa Lemah ( M ) Ket : ⋀ = pangkat. Konsentrasi ion OH- dari hidroksilamin bisa kita dapatkan dari PH nya dengan cara : = PH = 14 - pOH. = 11,25 = 14 - pOH.

MENGHITUNG PH ( LARUTAN ASAM & BASA) Belajar Asyik
Jika konsentrasi ion H + = 0,01 M, maka pH = - log 0,01 = 2. Jika konsentrasi ion H + = 0,001 M (10 kali lebih kecil) maka pH = - log 0,001 = 3 (naik 1 satuan) Jadi dapat disimpulkan: • Makin besar konsentrasi ion H + makin kecil pH. • Larutan dengan pH = 1 adalah 10 kali lebih asam daripada larutan dengan pH = 2. 2.

Rangkuman Materi Dan Contoh Soal Ph Larutan Asam Basa Dan Titrasi Asam Basa My XXX Hot Girl
Untuk mencari Mr, kita perlu menjumlahkan Ar dari seluruh atom penyusunnya. Nilai Ar dapat dilihat pada tabel periodik. Massa molekul relatif dapat dihitung menggunakan rumus berikut.$$\text{Mr} = \sum \limits_{i=1}^n (\text{Jumlah Atom}_i \cdot \text{Ar}_i)$$
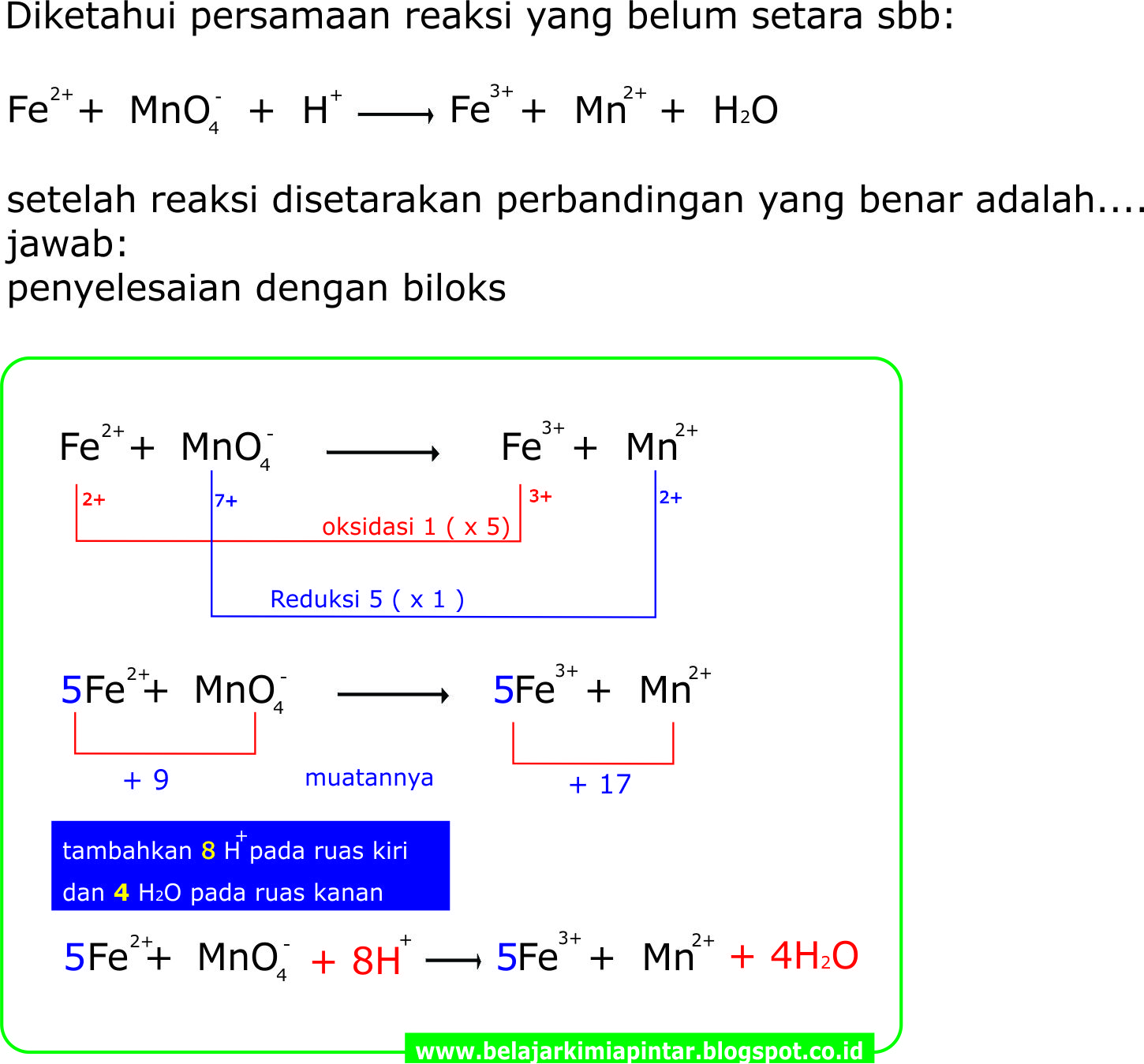
TRIK PENYETARAAN REAKSI REDOKS CARA BILOKS (SUASANA ASAM) KIMIA OKE PINTAR
Contoh Soal Larutan Campuran Asam Kuat dan Basa Kuat. 1. Sebanyak 200 ml NaOH 1 M dicampurkan dengan 300 ml NaOH 0,05 M. Hitunglah pH larutan campuran! 2. Sebanyak 50 ml larutan KOH 0,2 N direaksikan dengan 50 ml larutan H2SO4 0,05 M. Tentukanlah pH larutan tersebut!

Cara Mencari Adjoin Matriks Meteor
Cara Menuliskan Persamaan Ionik Bersih. Persamaan-persamaan ionik bersih adalah aspek yang penting untuk kimia karena persamaan ini hanya melambangkan wujud zat yang berubah dalam reaksi kimia.. Semua garam CO 3 2-, O 2-, S 2-, OH-, PO 4 3-, CrO 4 2-, Cr 2 O 7 2-, dan SO 3 2-tidak dapat larut (dengan beberapa perkecualian).. Mencari Massa.
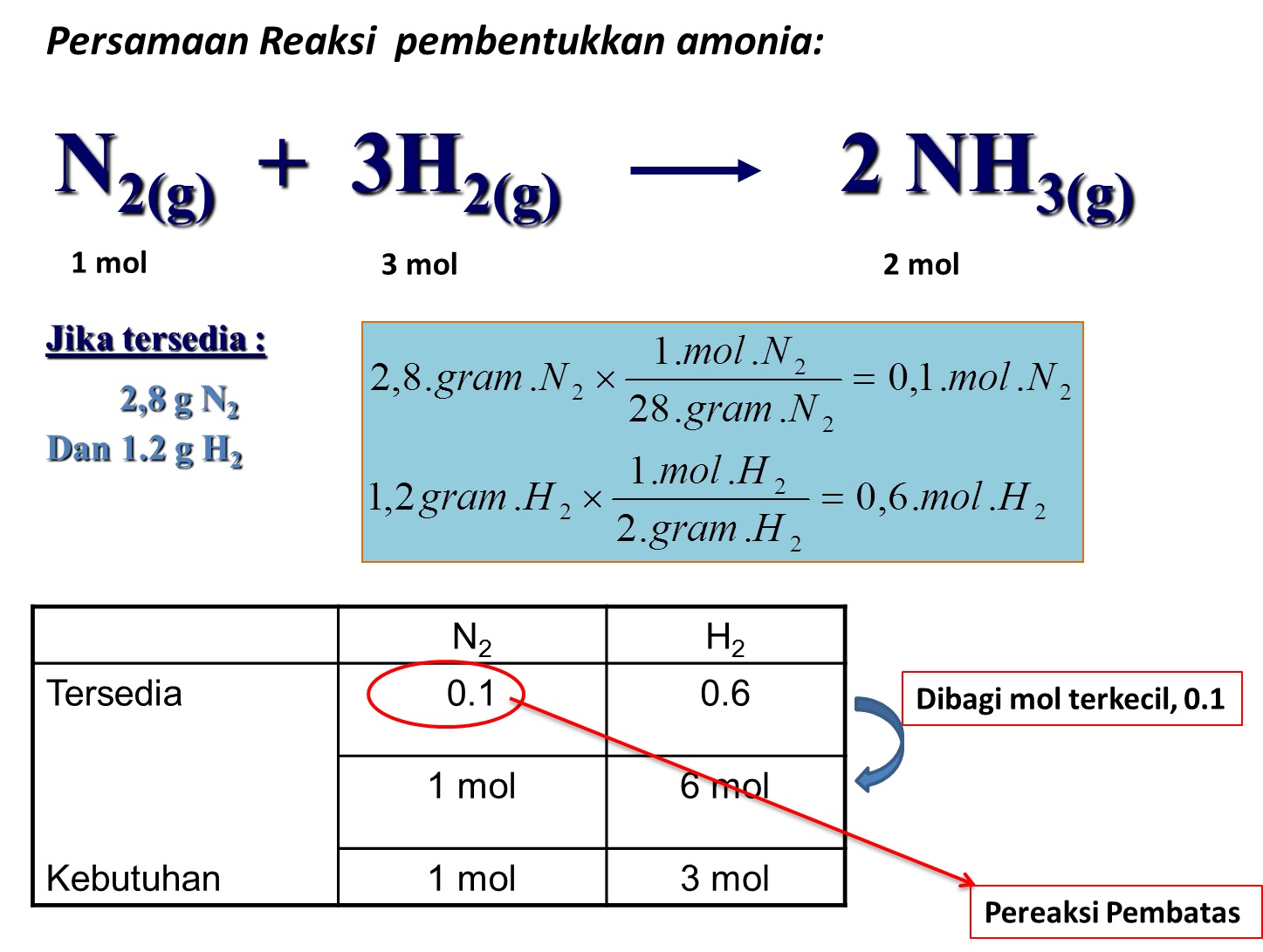
5 Tahapan Reaksi Kimia katelynjou.github.io
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.
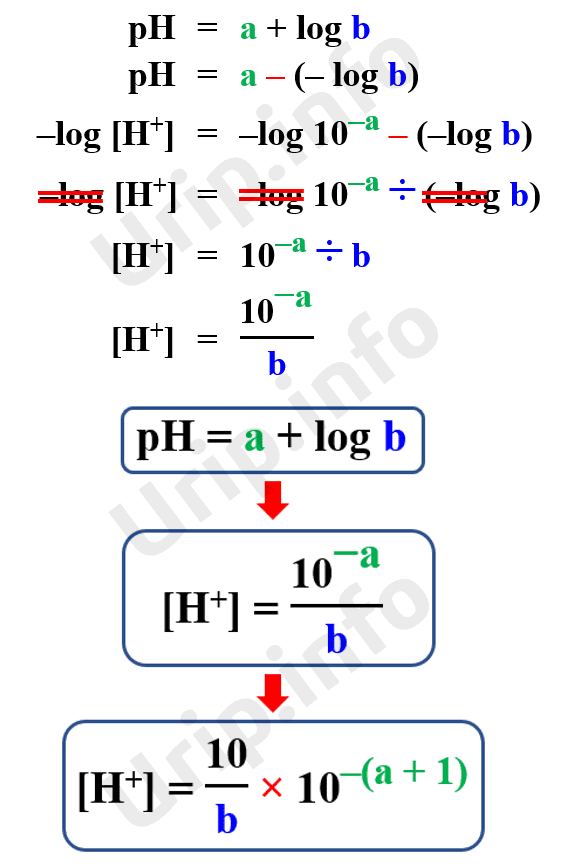
Tips Konversi pH atau pOH ke [H⁺] dan [OH⁻] Urip dot Info
Hubungan Kelarutan (s) dan Tetapan Hasil Kali Kelarutan (K sp) Kelarutan dari suatu zat dapat berubah bergantung pada beberapa faktor. Misalnya, kelarutan dari senyawa hidroksida seperti Mg (OH) 2, bergantung pada pH larutan. Kelarutan zat juga dipengaruhi oleh konsentrasi ion-ion lain dalam larutan, khususnya ion-ion senama.

Cara Mencari FPB Dan Contoh Soal Cilacap Klik
Yuk, tanya sekarang! Sekarang, kita lanjut lagi, ya! Kalau kamu perhatikan rumus Ar tadi, untuk menghitung Ar atau massa atom relatif, kita harus menghitung massa rata-rata dari 1 atom unsur yang mau kita hitung. Kenapa kita harus menentukan massa atom rata-rata dari setiap unsur? Jadi, atom-atom unsur yang sama, tidak selalu mempunyai massa.

Menghitung konsentrasi ion dalam KSP YouTube
M M g (OH) 2 = (7,25 : 58) x (1.000 : 250) = 0,50 M. Contoh 2. Sebanyak 10 gram NaOH (Mr = 40) dilarutkan ke dalam air sehingga volume larutan 2 liter. Tentukan molaritas larutan NaOH tersebut! Pembahasan: Dilihat dari soal, bisa diketahui bahwa volume zatnya berbentuk liter, maka cara mencari molaritas adalah dengan menggunakan rumus:

The Ksp for Cr(OH)3 is 1.6 × 10^30 . The molar solubility of this compound in water is
Jadi, bagaimana cara menghitung rumus berat ekuivalen? Ada beberapa langkah yang perlu kamu lakukan: 1. Tentukan elemen-elemen yang terdapat dalam molekul zat tersebut. Misalnya, jika kita ingin menghitung berat molekul air (H2O), maka elemen-elemennya adalah hydrogen (H) dan oxygen (O). 2.

Cara mencari korelasi dan regresi [PDF Document]
Persamaan pH dapat dilihat sebagai berikut: pH = -log [H3O + ]. Persamaan terkadang dapat dilihat sebagai pH = -log [H + ]. Ketahuilah bahwa persamaan yang memiliki H3O+ atau H+ sebenarnya adalah persamaan yang sama. Tidaklah penting untuk mengetahui arti log negatif agar dapat menghitung pH.

Cara Mencari Ide Konten Youtube Youtuber Pemula YouTube
Cara Mencari pOH Menggunakan Perhitungan Ada beberapa rumus berbeda yang dapat Anda gunakan untuk menghitung pOH, konsentrasi ion hidroksida, atau pH (jika Anda mengetahui pOH): pOH = -log 10 [OH - ]