
Lewis Dot Structure For Bf3
BeCl2 Lewis Structure. The electrons present in the outermost shell of an atom are shown in the Lewis structure of any molecule. These electrons will be both bonding as well as non-bonding electrons. The electronic configuration of beryllium is [He] 2s2and chlorine is [Ne] 3s23p5. The number of electrons on the valence shell of Be and Cl is 2.

Bentuk Molekul Teori Hibridisasi (Pembahasan Soal) YouTube
Hibridisasi - Pengertian, Cara Menentukan, dan Contoh Soal - Materi Kimia Kelas 10. by Zenius Writer. September 30, 2022. 0. Artikel ini bakal fokus ngebahas materi hibridisasi, bentuk molekul, cara menentukan, dan contoh soal hibridisasi orbital! Halo sobat Zenius! Dalam ilmu kimia kita mempelajari materi ikatan.

Explain the formation of the B{{F}_{3}} molecule using hybridisation.
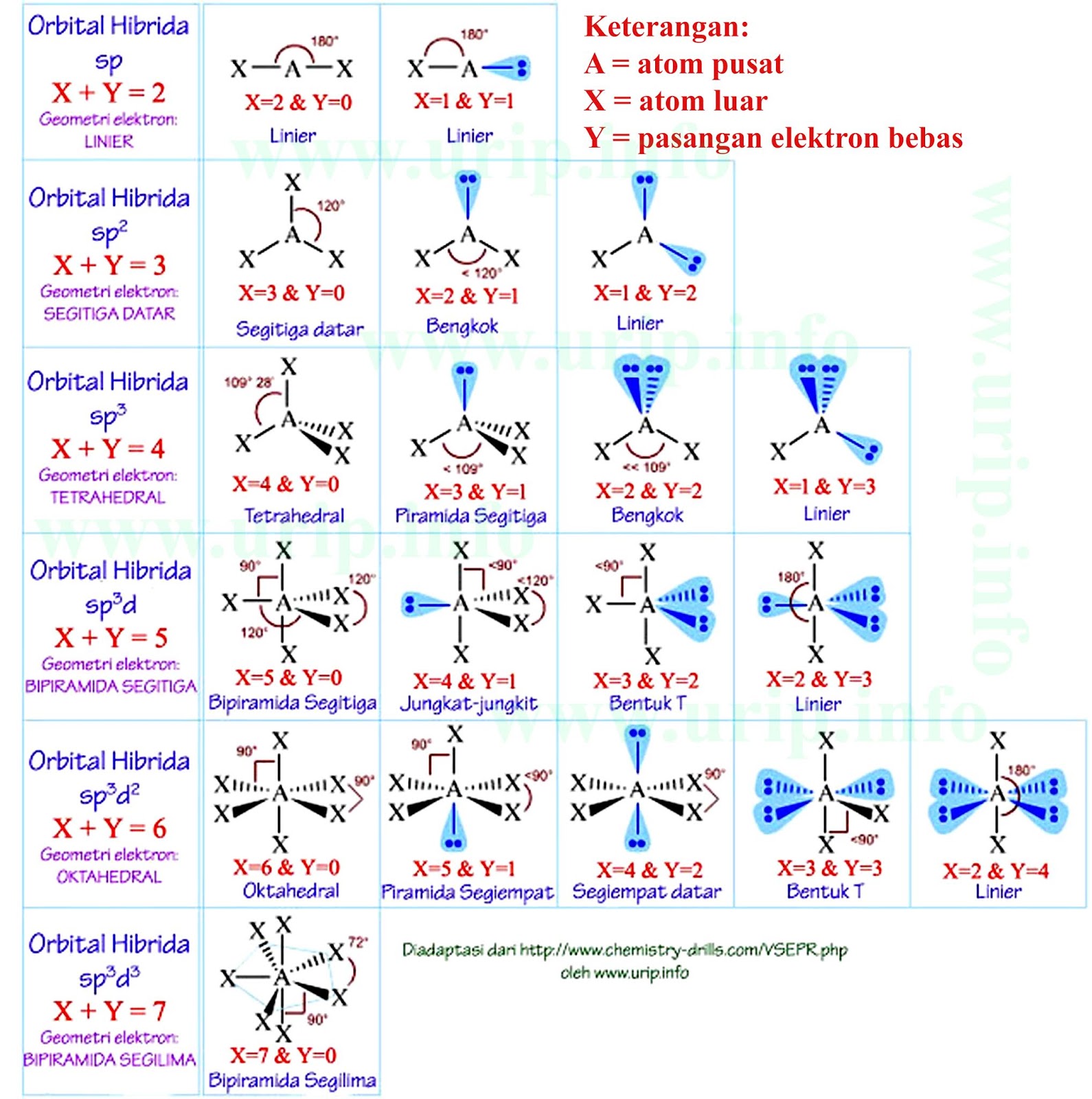
The five orbitals viz 1s, 3p, and 1d orbitals are free for hybridization. Therefore, it can obtain a set of 5sp 3 d hybrid orbitals directed to the 5 corners of a trigonal bipyramidal ( VSEPR theory ). The below diagram will help you depict easily. Hybridization of PCl 5. It is prominent that all the bond angles in trigonal bipyramidal geometry.

isti blogs Hubungan hibridisasi dengan panjang ikatan
This organic chemistry video tutorial explains the hybridization of atomic orbitals. It discusses how to determine the number of sigma and pi bonds in a mol.
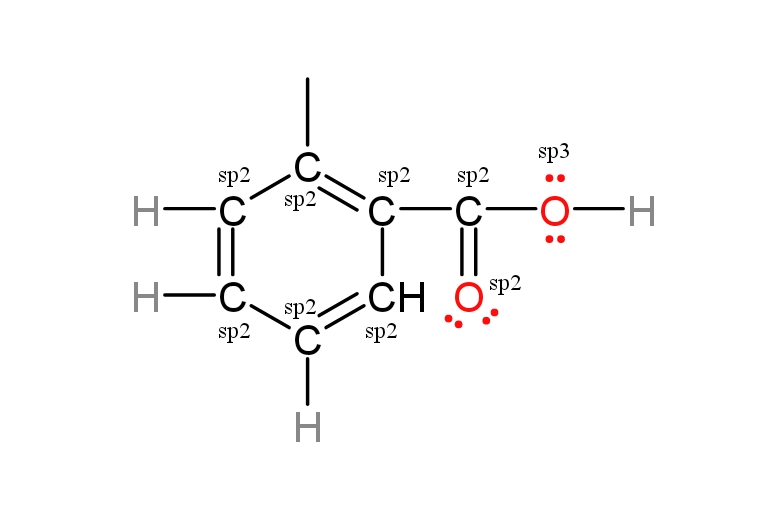
Tentukan hibridisasi dari struktur berikut ini
6 Macam Hibridisasi dan Contohnya. Hibridisasi terjadi ketika orbital dalam teori atom bercampur membentuk orbital atom baru. Orbital baru dapat menampung jumlah total elektron yang sama dengan yang lama. Sifat-sifat dan energi orbital hibridisasi yang baru adalah 'rata-rata' dari orbital asli yang tidak dikarbonisasi.

chemistry Is fluorine sp3 hybridized in BF3 Chemistry Stack Exchange
Orbital hybridisation. In chemistry, orbital hybridisation (or hybridization) is the concept of mixing atomic orbitals to form new hybrid orbitals (with different energies, shapes, etc., than the component atomic orbitals) suitable for the pairing of electrons to form chemical bonds in valence bond theory. For example, in a carbon atom which.

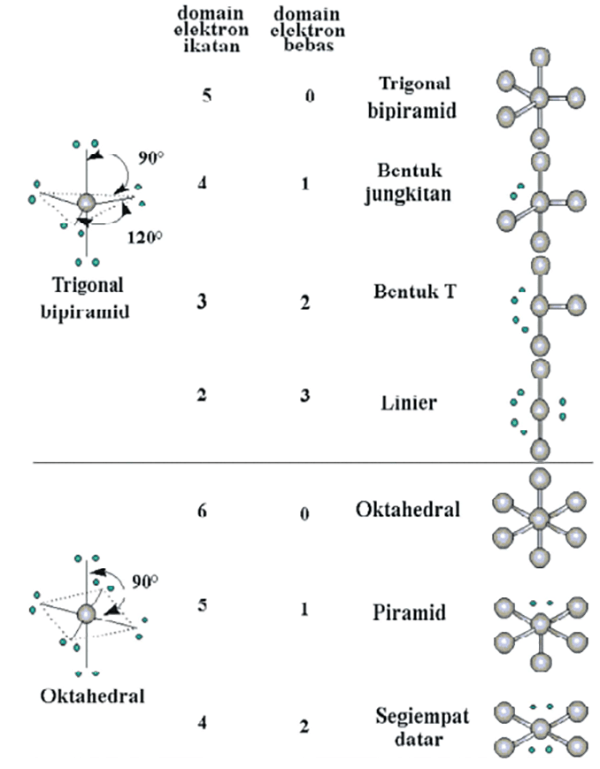
Berbagai Bentuk Molekul, Pengertian Teori Domain Elektron Dan Teori Hibridisasi Terlengkap
Dengan mengeksitasikan satu elektron 6 s ke orbital 6 p, kita memperoleh diagram orbital keadaan terksitasi Hg. Selanjutnya, orbital 6 s dan 6 p bercampur untuk membentuk dua orbital hibrida sp. Jadi, HgCl 2 membentuk orbital hibrida sp dengan bentuk molekul linear. Soal No. 2. Gambarkan proses hibridisasi dan tentukan bentuk molekul dari.

Brf3 Molecule
Untuk menentukan orbital molekul dan bentuk molekul dari senyawa digunakan hibridisasi dan pengisian orbital, Namun untuk menggambarkan hibridisasi dan orbitalnya perlu di konfigurasikan elektron atom pusatnya yaitu B. . Jumlah orbital s = 1 dan p = 3, maka orbital atom I dapat digambarkan : Jika diisi oleh 3 atom F maka orbital baru akan muncul dan menjadi :
Menentukan Jenis Hibridisasi, Bentuk Molekul dan Letak Atom O dalam Molekul SOF4 Urip dot Info
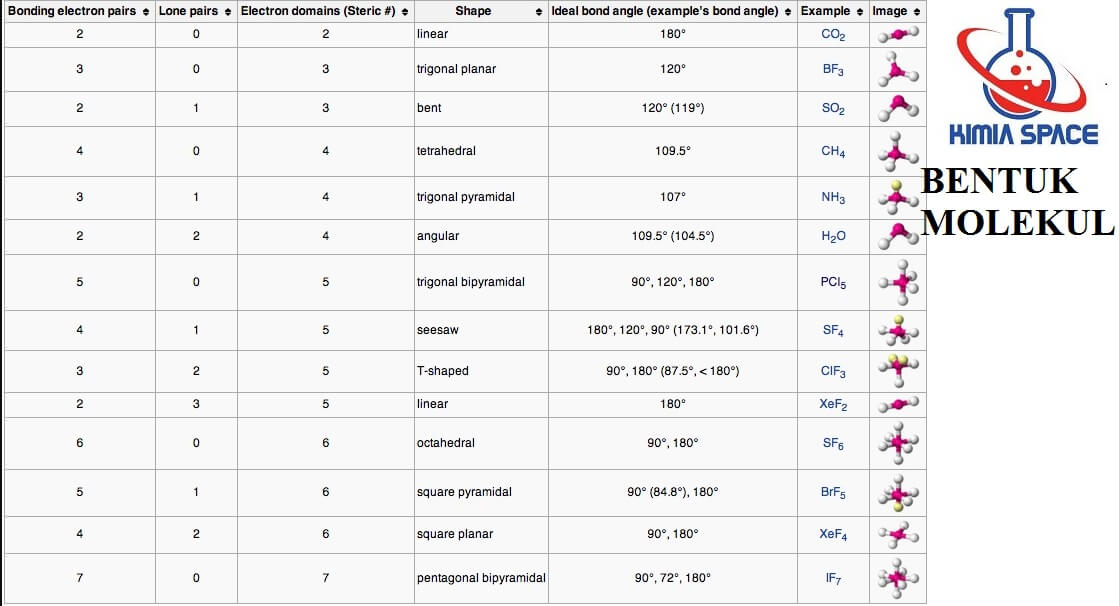
Hubungan antara jenis hibridisasi atom pusat dengan bentuk molekul. Bila dirangkum, maka berikut ini hubungan antara jenis hibridisasi atom pusat dengan bentuk molekul. Contoh Soal Teori VSEPR dan Pembahasannya. Tentukan tipe molekul untuk senyawa berikut! a. $\mbox{SF}_{4}$ b. $\mbox{BF}_{3}$ Jawaban. Kedua molekul ini memiliki ikatan tunggal.
Senyawaan Belerang, Ikatan Kimia, Hibridisasi, Bentuk Molekulnya Markas Belajar
Hibridisasi Kimia Kelas 10 - Pengertian, Tipe, Cara Menentukan, dan Contoh Soal. Hibridisasi adalah proses bergabungnya orbital atom pusat dengan orbital atom lainnya sehingga terbentuk orbital hibrida. Sedangkan bentuk molekul merupakan susunan atom-atom di dalam molekul dalam bentuk tiga dimensi. Artikel ini akan membahas bentuk molekul dan.

The formation of molecular complex BF3 NH3 results in a change in the hybridisation of boron
BF3 Lewis Structure, Molecular Geometry, and Hybridization. Boron Trifluoride (BF3) is an inorganic compound as it lacks a carbon atom or C-H bond in the molecule. Manufactured from the reaction of boron oxides and hydrogen fluoride, the chemical compound BF3 has a pungent smell and is colorless in nature. The compound behaves differently in.

(DOCX) Teori Hibridisasi LENGKAP DOKUMEN.TIPS
Soal No. 1 Ramalkan bentuk molekul BeCl2 dengan teori hibridisasi. (Ar Be: 4; Cl: 17) Penyelesaiannya: Kita tuliskan dulu konfigurasi elektron kedaan dasar atom Be. Karena akan berikatan dengan atom Cl, maka elektron terluar atom Be mengalami hibridisasi sehingga membentuk konfigurasi elektron terhibridisasi. Dua elektron tidak berpasangan pada orbital 2s dan 2p akan menerima elektron

Hibridisasi Orbital Atomatom pada CO2 YouTube
These are directed towards the four corners of a regular tetrahedron and make an angle of 109°28' with one another. The angle between the sp3 hybrid orbitals is 109.28 0. Each sp 3 hybrid orbital has 25% s character and 75% p character. Examples of sp 3 hybridization are ethane (C 2 H 6) and methane.

Bentuk Molekul berdasarkan Teori Domain Elektron dan Teori Hibridisasi Kimia Kelas 10
Molecular Geometry of BF3. The geometry of molecule of BF3 is 'Trigonal Planar.'. With the reference of Chemistry, 'Trigonal Planar' is a model with three atoms around one atom in the middle. It's like peripheral atoms all in one plane, as all three of them are similar with the 120° bond angles on each that makes them an equilateral.
Materi Hibridisasi Dan Contoh Soal Materi Soal
Hello there! Boron Trifluoride is an inorganic compound made up of one Boron atom and three Fluorine atoms. It is a Lewis acid, and to further check its prop.
Cara Menentukan Hibridisasi Dan Bentuk Molekul Materi Kimia Rezfoods Resep Masakan Indonesia
Chlorine trifluoride or ClF3 is an extremely reactive chemical compound with several varied applications and unique physical and chemical compounds. An interhalogen compound having both Cl and F, it has a density of around 3.79 g/l and a molar mass of 92.45 g/mol. ClF3 exhibits a strong suffocating pungent odor and varies from colorless gaseous.