
Contoh Senyawa Elektrolit Dan Non Elektrolit Gelinding Maju
Pengertian Larutan Elektrolit dan Non Elektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan listrik,. Contoh senyawa ionik antara lain NaCl, KBr, CuCl 2, Ca. Perbedaan utama larutan elektrolit kuat dan elektrolit lemah adalah daya hantarnya ketika konsentrasi kedua jenis elektrolit sama. Pada elektrolit kuat, elektrolit.

Materi Kimia Elektrolit dan Non Elektrolit YouTube
Pada akhirnya, ketiadaan proses itu menyebabkan arus listrik tidak bisa mengalir di larutan non elektrolit. Contoh larutan non elektrolit adalah alkohol (yang memiliki kandungan sebesar 70%), larutan urea, larutan gula, larutan glukosa, dan beberapa larutan lainnya. Berikut ini daftar perbedaan antara larutan elektrolit dan non elektrolit.

Larutan Elektrolit dan Non Elektrolit, Ini Contoh dan Perbedaannya!
Perbedaan utama antara larutan elektrolit dengan non elektrolit ialah terletak pada kemampuan menghantar listriknya. Namun, terdapat perbedaan larutan elektrolit dan non elektrolit yang lain, yaitu: Larutan elektrolit mempunyai derajat ionisasi antara 0 hingga 1, sedangkan derajat ionisasi larutan non elektrolit tidak ada atau 0..

Larutan Elektrolit dan Non Elektrolit (Kompone
Larutan elektrolit tinggi memiliki derajat ionisasi (α) yang mendekati 1, berarti zat terlarut hampi semuanya terionisasi. Adapun larutan elektrolit lemah memiliki derajat ionisasi jauh dibawah 1, berarti zat terlarut yang berubah menjadi ion hanya sedikit. Hal ini menyebabkan larutan elektrolit lemah menghantarkan listrik dengan kurang baik.
Larutan Elektrolit dan Non Elektrolit
Konsep larutan elektrolit dan non-elektrolit pertama kali dijelaskan oleh ahli kimia asal Swedia, Svante August Arrhenius, pada tahun 1884. Menurut Arrhenius yang dikutip dari Kimia Dasar II oleh Elvy Rahmi Mawarnis, senyawa elektrolit dalam air akan terurai menjadi partikel-partikel yang berupa atom atau gugus atom bermuatan listrik yang.

Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10
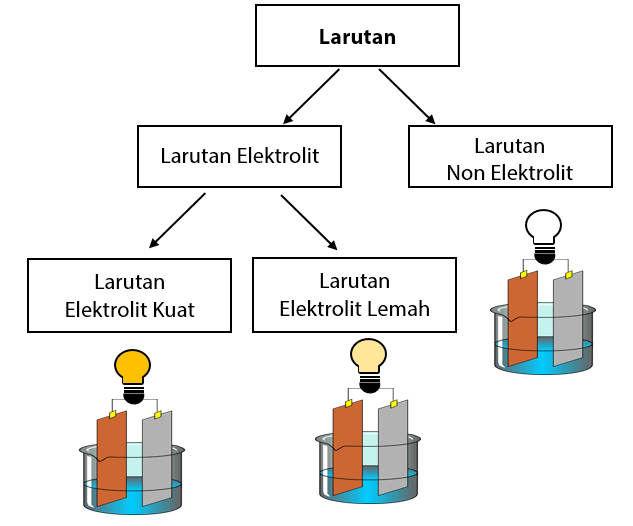
Larutan elektrolit dan non elektrolit memiliki karakteristik sifat yang berbeda. Perbedaannya adalah sebagai berikut: Sifat larutan elektrolit: Dapat menghantarkan listrik. Memiliki derajat ionisasi yang berkisar antara 0 < α ≤ 1. Jika dinyalakan uji daya hantar listrik: gelembung gas yang dihasilkan banyak, lampu menyala.

LARUTAN ELEKTROLIT DAN NONELEKTROLIT ( KIMIA SMA KELAS 10 ) YouTube
Berikut adalah manfaat larutan non elektrolit. 1. Sebagai sumber energi. Gula adalah salah satu komponen larutan non elektrolit. Gula ini merupakan sumber energi dalam bentuk karbohidrat sederhana. Ketika tubuh manusia kekurangan gula, maka akan terasa lelah, jantung berdebar, dan sulit berkonsentrasi.

Contoh Larutan Elektrolit Kuat Lemah Beserta Perbedannya Riset
Larutan Elektrolit dan Non-Elektrolit: Sejarah Penemuan Larutan Elektrolit dan Non-Elektrolit. Penemuan larutan elektrolit dan non-elektrolit ternyata berhubungan dengan ilmuwan asal Swedia, Svante August Arrhenius (1859-1927). Kala itu ia tengah melakukan presentasi disertasi untuk gelar PhD-nya di Universitas Uppsala tahun 1884.

Larutan Elektrolit dan Nonelektrolit
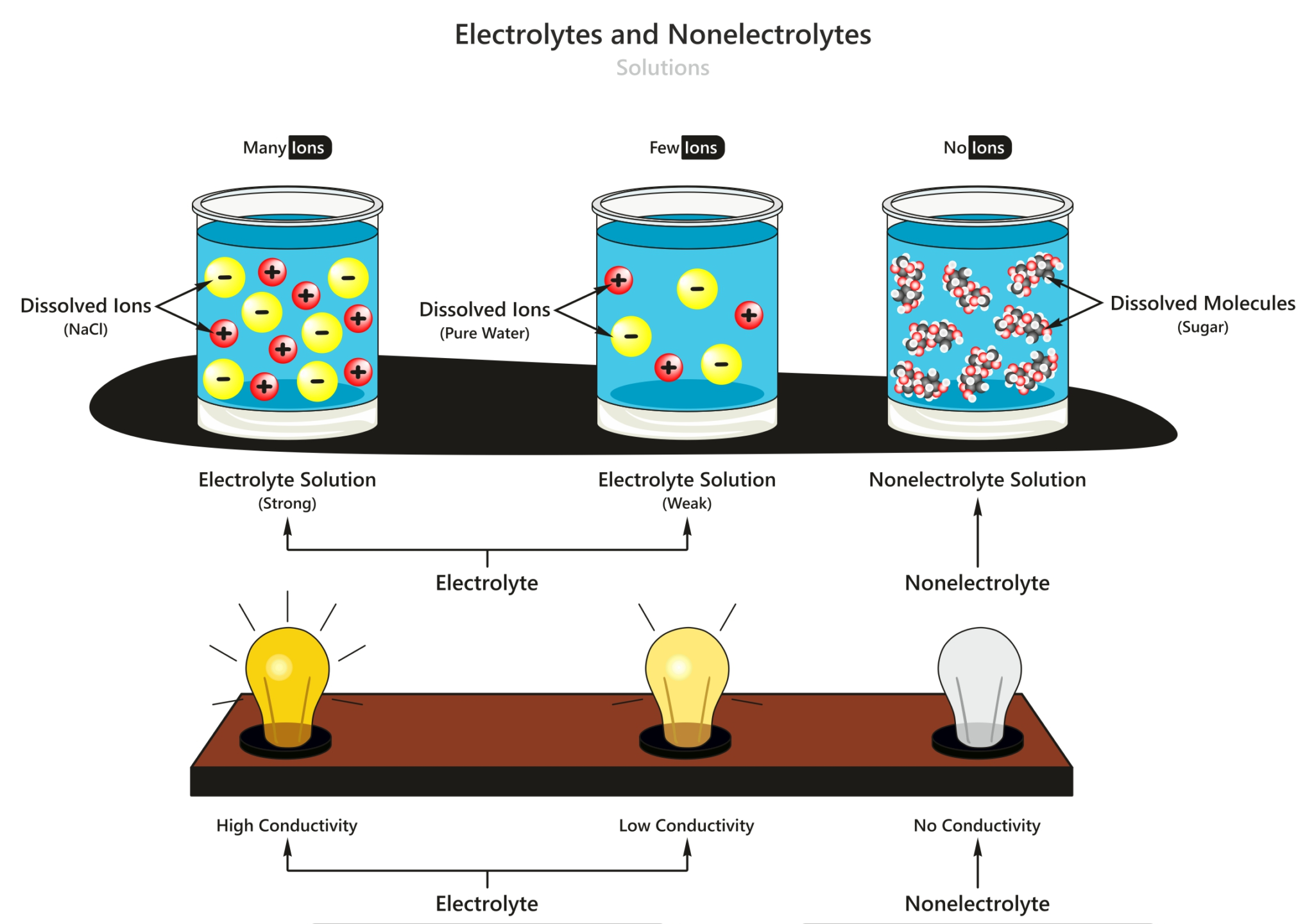
Ketika larutan non-elektrolit dilarutkan dalam air, zat tersebut tidak terurai menjadi ion- ion seperti pada larutan elektrolit. Contoh larutan non-elektrolit adalah gula (sukrosa), urea, dan etanol. Perbedaan antara larutan elektrolit dan non-elektrolit dapat dilihat dari beberapa aspek, yaitu konduktivitas, titik didih, dan sifat larutan.
Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
Singkatnya, berikut perbedaan antara larutan elektrolit dan non elektrolit: 1. Kemampuan menghantarkan listrik. Larutan elektrolit mampu menghantarkan listrik baik itu kuat maupun lemah atau mudahnya larutan elektrolit berperan sebagai konduktor. Sedangkan larutan non elektrolit tidak dapat menghantarkan listrik atau dapat disebut sebagai isolator.

Soal Larutan Elektrolit Dan Nonelektrolit Satu Trik
Sifat-sifat Larutan Elektrolit dan Non Elektrolit.. ( N a C l NaCl ) merupakan larutan elektrolit atau non elektrolit. Jelaskan alasan Anda.. Perbedaan utama antara larutan elektrolit kuat dan elektrolit lemah adalah sejauh mana disosiasi ionik terjadi dalam larutan.

Larutan Elektrolit dan Non Elektrolit (Kimia SBMPTN, UN, SMA) YouTube
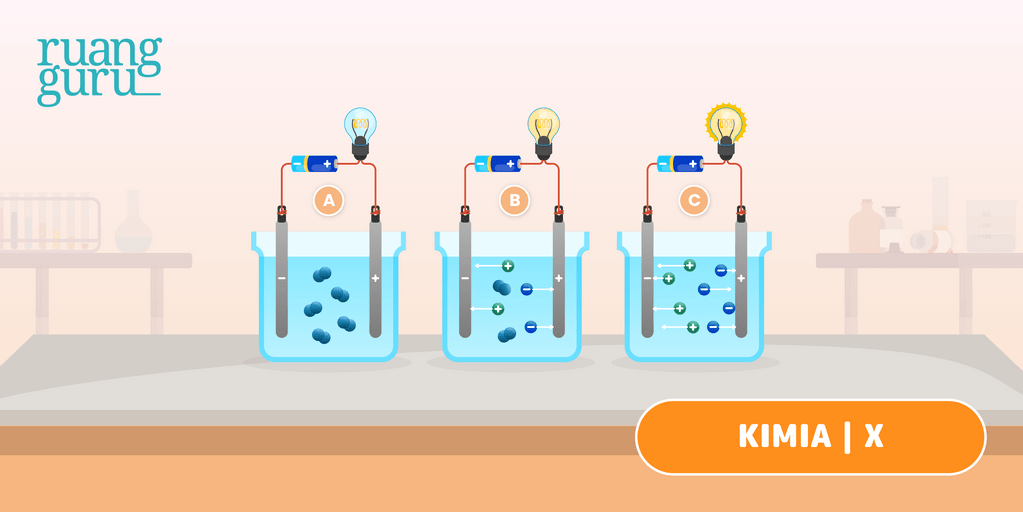
Seperti namanya, larutan non-elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Jika disekitar penghantar listrik (electrode) tidak muncul gelembung-gelembung gas, dan lampu tidak menyala ketika diuji. Ciri-ciri dari larutan non-elektrolit: Pada larutan non elektrolit, senyawa dalam air tidak mengalami proses ionisasi.
Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10 Belajar
Pengertian larutan elektrolit. Larutan elektrolit adalah larutan yang dapat mengantarkan listrik sehingga dapat menyalakan lampu atau menimbulkan gelembung gas di sekitar elektrodanya. Baca juga: Pengertian Larutan, Suspensi, dan Koloid. Larutan elektrolit mengandung partikel-partikel yang bermuatan, yakni kation dan anion.

PPT ** Tugas bahan ajar Kimia** PowerPoint Presentation, free download ID5411227
Penjelasan: jelaskan perbedaan antara larutan elektrolit dan non elektrolit. 1. Larutan elektrolit mengandung ion-ion yang dapat menghantarkan arus listrik. Larutan elektrolit mengandung ion-ion yang dapat menghantarkan arus listrik. Ion-ion ini terbentuk ketika senyawa ionik seperti garam atau asam dilarutkan dalam air.

SifatSifat Larutan Elektrolit dan Nonelektrolit Memotivasi Diri
Larutan elektrolit yang memberikan gejala berupa lampu menyala dan membentuk gelembung gas disebut elektrolit kuat. Contohnya yaitu HCl, air aki, air laut, dan air kapur. Adapun elektrolit yang tidak memberikan gejala lampu menyala tetapi menimbulkan gelembung gas termasuk elektrolit lemah. Contohnya yaitu larutan amonia, larutan cuka,dan.

Mengenal Larutan Elektrolit dan Non Elektrolit Kimia Kelas 10
Jika dibandingkan, larutan elektrolit dan larutan non-elektrolit dengan konsentrasi yang sama akan memiliki jumlah partikel yang berbeda. Jumlah partikel larutan elektrolit lebih banyak daripada larutan non-elektrolit sehingga sifat koligatifnya pun akan lebih besar. ΔP = P⁰.