
MENGHITUNG PH ( LARUTAN ASAM & BASA) Belajar Asyik
Cara Membedakan Asam dan Basa. Senyawa asam dapat dengan mudah ditemukan pada buah-buahan, seperti jeruk dan lemon. Selain itu, bisa juga ditemukan pada bahan makanan, seperti cuka. Bahkan, senyawa asam juga banyak digunakan sebagai bahan pengawet makanan lho, misalnya asam benzoat yang dimanfaatkan sebagai pengawet jus buah dan selai.

Unduh Diagram Penambahan Sedikit Asam Kuat dan Basa Kuat ke dalam Larutan Penyangga Urip dot Info
Basa Kuat. Basa kuat adalah larutan yang menghasilkan banyak ion dan terurai secara sempurna saat dilarutkan dalam air. Karena terionisasi sempurna, sehingga derajat ionisasinya (α=1). Contohnya adalah NaOH, KOH, LiOH, dan Ba(OH)2. Berikut ini merupakan rumus ionisasi basa kuat: [OH-] = x . [M(OH)x]

MENGHITUNG PH ( LARUTAN ASAM & BASA) Belajar Asyik
Secara umum, reaksi kesetimbangan larutan basa LOH dalam air dapat ditulis sebagai berikut. LOH(aq) ⇌ L + (aq) + OH − (aq) Tetapan ionisasi basa K b dapat dirumuskan seperti berikut. basa kuat (contoh: NaOH, KOH, Ca(OH) 2, Sr(OH) 2, Ba(OH) 2) Dalam air, hampir seluruh basa kuat terurai menjadi ion-ionnya, sehingga derajat ionisasi α ≈ 1.

Menghitung pH Campuran Asam Kuat dan Basa Kuat ( Asam Basa Kimia SMA Kelas 11 ) YouTube
1. Titrasi asam kuat-basa kuat. Pada terjadinya proses titrasi asam kuat dan basa kuat, maka kedua larutan akan terionisasi secara sempurna. Hal tersebut, disebabkan karena asam kuat dan basa kuat termasuk ke dalam larutan dengan kemampuan elektrolit kuat. Sehingga memungkinkan terjadinya ionisasi sempurna di dalam air.

Larutan Basa Materi Kimia Kelas 11 Zenius Blog
Pengertian basa kuat adalah senyawa basa yang akan terurai sempurna jika terlarut dalam air. Misalnya pada senyawa: NaOH, KOH, Ba(OH)2.-Basa lemah Pengertian basa lemah adalah senyawa basa yang tidak sempurna proses pelarutan atau terurainya jika ada dala air. Misalnya pada senyawa basa NaHCO3, NH4OH.

Perhatikan Tabel Berikut Pasangan Larutan Yang Bersifat Basa Adalah Homecare24
Dengan demikian, basa kuat memiliki konsentrasi ion hidroksida (OH-) yang tinggi dalam larutan. Contoh basa kuat antara lain natrium hidroksida (NaOH) dan kalium hidroksida (KOH). Perlu dicatat juga bahwa kekuatan suatu asam atau basa tidak terkait dengan konsentrasinya dalam larutan. Akan tetapi, kekuatan larutan asam dan basa mengacu pada.

Pengertian, Ciriciri, dan Contoh Larutan Basa Varia Katadata.co.id
Larutan tersebut bisa mengalami disosiasi total dalam larutan. Sementara basa kuat adalah senyawa basa yang bila dilarutkan dalam air akan melepaskan ion OH - dengan mudah. Sementara itu, asam kuat + basa kuat = netral. Artinya apabila reaksi asam kuat dicampurkan dengan basa kuat akan menghasilkan larutan dengan pH 7 atau netral. Asam basa lemah

Kimia Larutan Asam Kuat & Basa Kuat SMA PPLS YouTube
Titrasi basa kuat oleh asam kuat, artinya: Titran (larutan standar pada buret) → asam kuat. Titrat (larutan sampel pada labu erlenmeyer) → basa kuat. Titrasi basa kuat oleh asam kuat akan menghasilkan kurva sebagai berikut. 3. Titrasi Asam Lemah oleh Basa Kuat.

Cara Menghitung Ph Larutan Asam Kuat Dan Asam Lemah Panduan Kimia Riset Sexiz Pix
Untuk asam kuat dan basa kuat, kurvanya akan relatif mulus dan sangat tajam di sekitar titik ekuivalen.. Titrasi asam-basa bergantung pada netralisasi antara asam dan basa ketika dicampur dalam larutan. Selain sampel, indikator pH yang sesuai ditambahkan ke bejana titrasi, yang mewakili rentang pH pada titik ekuivalen. Indikator asam.

MENGHITUNG PH ( LARUTAN ASAM & BASA) Belajar Asyik
Basa memiliki rasa pahit. Nilai pH larutan basa lebih dari 7, menunjukkan sifat basanya. Skala pH logaritmik yaitu semakin tinggi nilai pH, semakin kuat sifat basanya. Basa kuat memiliki nilai pH mendekati 14, basa lemah mendekati 7. Indikator asam-basa lakmus berubah jadi biru (basa) atau merah (asam).

Tabel Indikator Asam Basa
Basa kuat adalah adam love Valen sederhana yang dapat mendeprotonasi asam sangat lemah di dalam reaksi asam-basa.. Basa lemah adalah larutan basa tidak berubah seluruhnya menjadi ion hidroksida dalam larutan. Amonia adalah salah satu contoh basa lemah. Sudah sangat jelas amonia tidak mengandung ion hidroksida, tetapi amonia bereaksi dengan.

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
Titrasi asam lemah dengan basa kuat. Sebagai contoh, 40 mL larutan CH 3 COOH 0,1 M ditetesi dengan larutan NaOH 0,1 M sedikit demi sedikit. Berikut kurva titrasi berwarna biru yang menggambarkan perubahan pH selama titrasi tersebut dibandingkan dengan kurva titrasi HCl dengan NaOH yang berwarna merah.
Soal Larutan Asam Basa
2. Reaksi antara asam kuat dan basa lemah. Reaksi asam dan basa juga bisa terjadi pada larutan dengan asam kuat dan larutan dengan basa lemah. Contoh: HBr (aq) + NH 3(aq) → NH 4 Br (aq) Dari contoh di atas, dapat diketahui bahwa HBr adalah asam kuat, sedangkan NH3 adalah basa lemah. Hasil reaksi antara asam kuat dan basa lemah ini dapat.
Daftar Nama AsamBasa Kuat dan AsamBasa Lemah
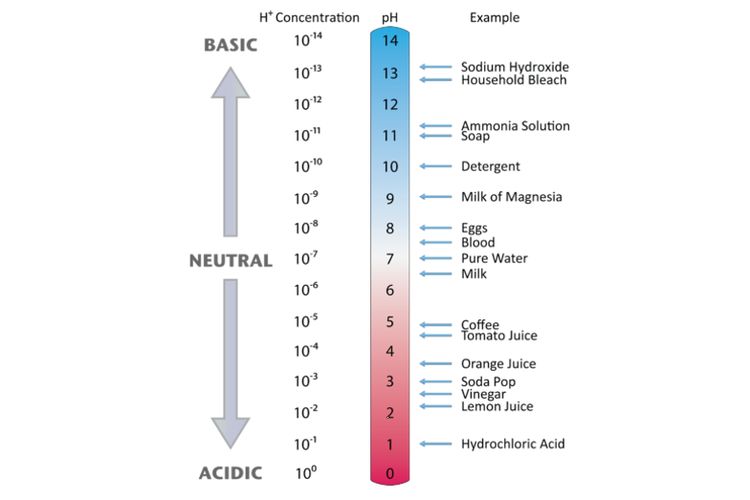
Kalau pada suhu 25℃, pH < 7 bersifat asam, pH = 7 bersifat netral, dan pH > 7 bersifat basa. Derajat keasaman dan kebasaan suatu larutan. (dok. Flickr/boellstiftung) Semakin kecil nilainya, maka larutan tersebut akan semakin asam. Misalnya antara larutan dengan pH 3 dan 1, akan lebih kuat konsentrasi asam dengan pH 1 daripada 3.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Larutan basa (sodium stearat) atau amonium hidroksida encer membuat rambut kasar dan membuka atau merenggangkan kutikula, serta membuat rambut kering dan kusut. Sementara itu larutan basa kuat (pH = 10 - 14) malah dapat membuat rambut rontok melarutkan komponen-komponen penyusun rambut.

Soal Larutan Asam Basa
Asam dan basa adalah dua jenis larutan yang sering digunakan dalam kehidupan sehari-hari. Klasifikasi asam dan basa. Larutan asam dan basa diklasifikasikan menjadi dua jenis, yaitu sebagai berikut: Asam kuat dan basa kuat. Asam kuat merupakan senyawa asam yang dapat dengan mudah melepaskan ion H+ di dalam air dan dalam larutannya terjadi.