
Soal Larutan berikut yang mempunyai fraksi mol terbesar adalah
Larutan berikut yang mempunyai fraksi mol terbesar adalah.. Larutan urea 10% (Mr = 60) Larutan glukosa 20% (Mr = 180) Larutan NaCl 10% (Mr = 58,5). Fraksi mol etanol (Mr = 46) dalam larutan etanol 46% massa adalah.. 0,025. 0,075. 0,25. 0,75. 1,00. 14. Multiple Choice. Edit. 2 minutes. 1 pt.

Kumpulan Contoh Soal Fraksi Mol dan Pembahasannya Terbaru 2022 Halaman 4
Fraksi Mol dalam Kimia Fraksi mol adalah ukuran konsentrasi larutan yang menyatakan perbandingan jumlah mol sebagian zat terhadap jumlah mol total komponen larutan. Dalam kimia, fraksi mol didefinisikan sebagai jumlah konstituen dibagi dengan jumlah total semua konstituen dalam suatu campuran : Jumlah semua fraksi mol sama dengan 1: Fraksi mol juga disebut fraksi jumlah dan identik dengan.

Larutan berikut yang memiliki fraksi mol ter kecil adala...
Soal dan Jawaban Konsentrasi Larutan: Molaritas, Molalitas, Fraksi Mol, Persen Berat, Normalitas. 1. Konversi molal ke % massa. Contoh soal: Hitunglah % massa dari larutan NaI 0,2 molal (massa molar NaI = 150 g/mol) Penyelesaian: Arti 0,2 molal NaI adalah 0,2 mol NaI dalam 1 Kg pelarut air. massa NaI sebanyak 0,2 mol = 0,2 mol x 150 g/mol = 30.

Contoh Soal Fraksi Mol Dan Pembahasannya
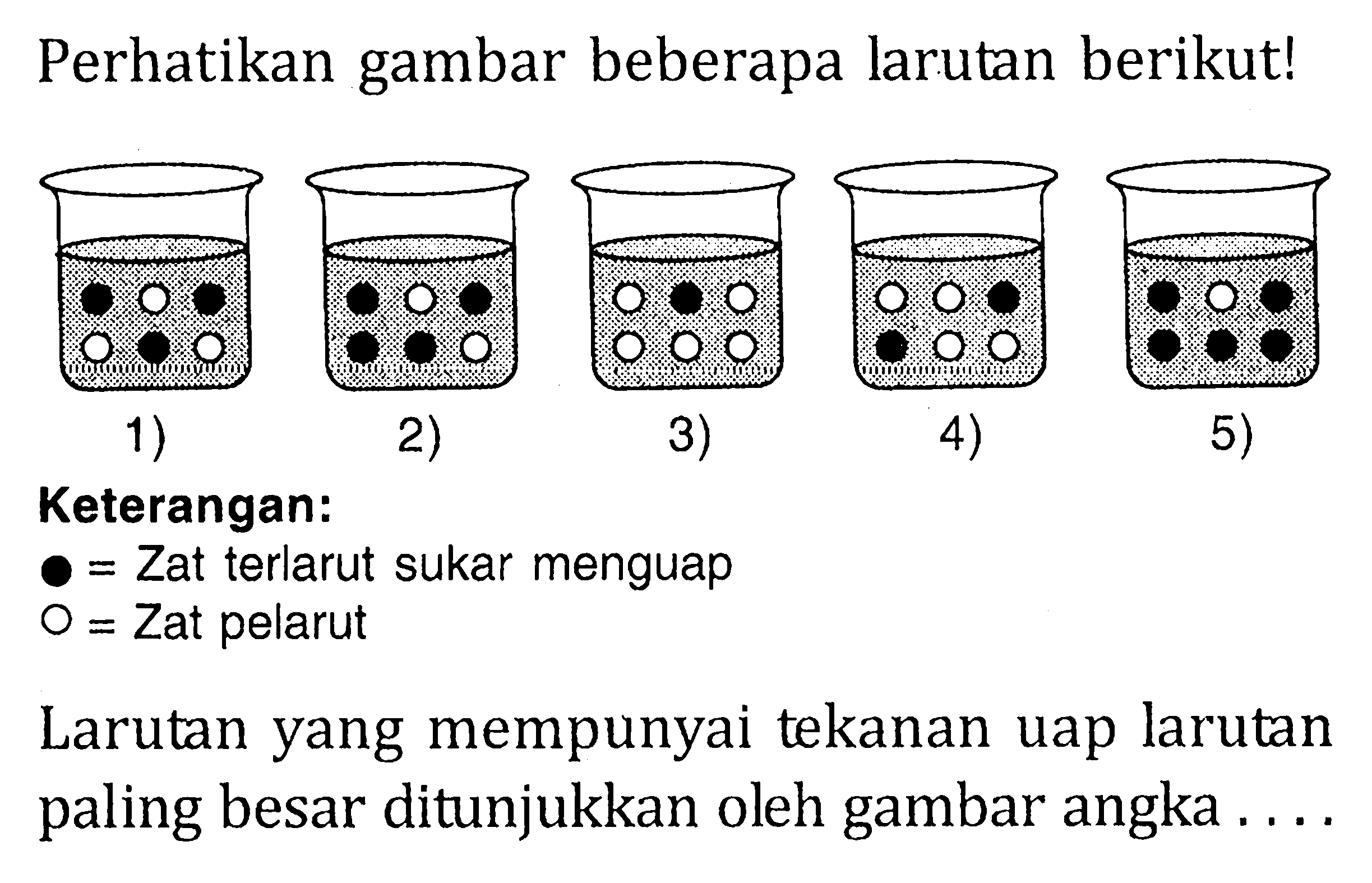
Larutan yang memiliki tekanan uap paling besar adalah larutan yang memiliki fraksi mol pelarut paling besar. Dari gambar pada soal, larutan yang memiliki perbandingan zat pelarutdan zat terlarut paling besarterdapat pada larutan nomor 3). Jadi, larutan yang mempunyai tekanan uap larutan paling besar ditunjukkan oleh gambar angka 3).

Contoh Soal Molalitas dan Fraksi Mol larutan LABORATORIUM SMK
Satuan Konsentrasi Larutan; Larutan berikut yang mempunyai fraksi mol terbesar adalah . . . . A. larutan urea 10% (Mr = 60) B. larutan glukosa 20% (Mr = 180) C. larutan NaCl 10% (Mr = 58,5) D. larutan sukrosa 30% (Mr = 342) E. larutan MgSO4 20% (Mr = 120) Satuan Konsentrasi Larutan; Sifat Koligatif Larutan; Kimia Fisik dan Analisis
Perhatikan grafik berikut! Jika jumlah mol partikel pelar...
Maka, jawabannya adalah n p = d. 0,8 mol. 2. Suatu larutan, memiliki fraksi mol zat terlarut sebesar 0,2. Jika ke dalam larutan tersebut ditambahkan lagi zat terlarut yang sama sebanyak 0,2 mol, fraksi mol zat terlarutnya menjadi 1 / 3. Maka banyaknya mol zat terlarut awal dalam larutan tersebut adalah…. a. 0,1 mol. b. 0,2 mol. c. 0,3 mol. d.

Fraksi Mol Sifat Koligatif Larutan YouTube
KOMPAS.com - Dilansir dari Encyclopedia Britannica (1999), Fraksi mol merupakan salah satu satuan konsentrasi larutan selain molalitas dan juga molaritas. Fraksi mol adalah perbandingan jumlah mol suatu zat (nt) dalam larutan dengan jumlah mol seluruh zat (np) dalam larutan. Fraksi mol dirumuskan sebagai berikut: persamaan fraksi mol terlarut.

Contoh Soal Dan Pembahasan Fraksi Mol Soal Kelasmu
Fraksi mol adalah perbandingan antara jumlah zat suatu komponen (bisa pelarut maupun zat terlarut) dan jumlah zat total atau mol zat totalnya. Mol zat total meliputi mol pelarut dan mol zat terlarut. Di dalam Kimia, penentuan fraksi mol merupakan hal yang paling penting untuk dilakukan. Mengingat, semua sifat-sifat fisik dari suatu larutan.

Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40 (Mr NaOH = 40
5. Fraksi mol natrium hidroksida suatu larutan NaOH dalam air adalah 0,05. Kemolalan larutan natrium hidroksida adalah. Jawaban:-Fraksi mol NaOH = 0,05-Fraksi mol air = 1 - 0,05 = 0,96-Mr air = 18 molalitas = 0,05 x 1.000 = 2,92 0,95 x 18. Detikers, sudah paham kan pengertian dan contoh soal fraksi mol? Selamat belajar ya!

Soal Fraksi Mol Sinau
Maka: mol MgSO₄ = 20 gram / 120 = 0,1667 mol mol pelarut (air) = 80 gram / 18 = 4,4444 mol Fraksi mol MgSO₄ = 0,1667 mol / (0,1667 mol + 4,4444 mol) Fraksi mol MgSO₄ = 0,1667 mol / 4,6111 mol Fraksi mol MgSO₄ = 0,0361 D. Larutan NaCl 10% (Mr = 58,5) Kandungan NaCl adalah 10 % misalkan adalah 10 gram maka kandungan pelarutnya adalah 90%.

Rumus Fraksi Mol Pengertian, Sifat dan Contoh Soalnya Lengkap BprsKu.Co.Id
Agar lebih memahami tentang pengertian dan rumus fraksi mol, maka sebaiknya berlatih soal adalah hal yang paling ampuh, dibawah ini contoh - contoh soal fraksi mol lengkap dengan pembahasannya. Contoh Soal 1. Sebuah larutan terdiri dari 3 mol zat A, 3 mol zat B, dan 4 mol zat C. Hitung fraksi mol dari masing - masing zat tersebut ? Pembahasan :

Soal Larutan berikut yang mempunyai fraksi mol terbesar adalah
Fraksi mol menunjukkan komposisi zat di dalam suatu campuran. Jika diasumsikan semua larutan memiliki massa 100 g, maka: A. Larutan Urea 10%, mengandung 10 g Urea dan 90 g Air B. Larutan Glukosa 20%, mengandung 20 g Glukosa dan 80 g Air C. Larutan NaCl 10%, mengandung 10 gram NaCl dan 90 gram Air D. Larutan sukrosa 30%, mengandung 30 gram sukrosa dan 70 gram Air E. Larutan 20%, mengandung 20.

Larutan Berikut Yang Memiliki Fraksi Mol Terkecil Adalah
Fraksi mol menunjukkan komposisi zat di dalam suatu campuran. Jika diasumsikan semua larutan memiliki massa 100 g, maka: A. Larutan Urea 10%, mengandung 10 g Urea dan 90 g Air

Molalitas dan Fraksi Mol Larutan KOH no 3 hal 8 Erlangga YouTube
Jadi, fraksi mol masing - masing adalah : X A = 0,25. X B = 0,5. X C = 0,25. Dari ketiga fraksi mol di atas, jika dijumlahkan harus menghasilkan 1 sesuai rumus : X A + X B + X C = 1. 0,25 + 0,5 + 0,25 = 1. Demikian pembahasan dari kami, semoga bermanfaat dan menambah wawasan serta pengetahuan kalian. Sekian terima kasih.

Larutan dengan pelarut air berikut memiliki fraksi mol ya...
Adapun persamaan fraksi mol adalah sebagai berikut. Keterangan: X t = fraksi mol zat terlarut; X p = fraksi mol pelarut; n t = mol zat terlarut; dan. n p = mol zat pelarut. 8. Pengenceran. Untuk mengurangi tingkat kepekatan suatu larutan, Quipperian bisa melakukannya dengan menambahkan air. Metode ini dikenal sebagai pengenceran. Larutan yang.

Zat berikut yang memiliki jumlah mol terbesar adalah....
Hai CoFriends, yuk latihan soal ini:Larutan berikut yang mempunyai fraksi mol terbesar adalah . . . . A. larutan urea 10% (Mr = 60) B. larutan glukosa 20% (M.