
Reaksi Kimia Akan Semakin Cepat Apabila mari semua dansa denganku lirik
Apabila diketahui data dari suatu reaksi yang menghasilkan gas oksigen berikut: Laju reaksi ini dinyatakan dalam laju pertambahan produk, yakni oksigen, dan dapat disajikan sebagai: 1. Laju rata-rata. Laju rata-rata, yakni laju reaksi rata-rata untuk selang waktu tertentu. Misalkan dari data diatas, laju reaksi rata-rata setelah 3 menit adalah:

Satuan Tetapan Laju Reaksi K Untuk Reaksi Orde 2 Adalah
Pengertian Laju Reaksi. Laju reaksi adalah perubahan konsentrasi dari reaktan ataupun produk per satu satuan waktu. Untuk reaksi dengan reaktan A dan B menghasilkan produk C dan D seperti pada rumus persamaan reaksi berikut, seiring waktu jumlah molekul reaktan A dan B akan berkurang dan jumlah molekul produk C dan D akan bertambah, dan rumus.

23+ Contoh Soal C1 Sampai C6 Laju Reaksi Contoh Soal dan Jawaban
Sehingga laju reaksinya V = k [ NO 2] 2. Pertanyaan ke 2 dari 5. 2. Pertanyaan. Diketahui reaksi: Reaksi 1: NO 2 ( g) +NO 2 ( g) → NO 3 ( g) +NO ( g) lambat. Reaksi 2: NO 3 ( g) +CO ( g) → NO 2 ( g) +CO 2 ( g) cepat. Berdasarkan reaksi di atas, zat intermediet reaksi adalah. . 1.

Menentukan laju reaksi
20 questions. 1. Multiple Choice. 2 minutes. 1 pt. Diantara pasangan pereaksi berikut, yang diharapkan bereaksi paling cepat adalah.. 20 ml HCl 0,2 M + 20 ml Na 2 S 2 O 3 0,1M pada suhu 30 o C. 20 ml HCl 0,1 M + 20 ml Na 2 S 2 O 3 0,1M + 10 ml air pada suhu 30 o C. 20 ml HCl 0,1 M + 20 ml Na 2 S 2 O 3 0,1M pada suhu 40 o C.

Persamaan Laju Reaksi dan Orde Reaksi Laju Reaksi Kimia Kelas 11 YouTube
Laju reaksi adalah laju berkurangnya konsentrasi reaktan atau laju bertambahnya konsentrasi produk. Tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat. Salah satu faktor yang dapat mempercepat laju reaksi adalah luas permukaan zat, makin luas permukaan zat, maka laju reaksi makin cepat.

Menentukan laju reaksi
5. Reaksi berikut yang mempunyai laju reaksi paling cepat adalah.. a. 3 gram batang Mg + larutan HCL 0,01 M b. 3 gram batang Mg + larutan HCL 0,1 M c. 3 gram serbuk Mg + larutan HCL 0,1 M * d. 3 gram serbuk Mg + larutan HCL 0,001 M e. 3 gram serbuk Mg + larutan HCL 0,01 M. 6. Kenaikkan suhu akan mempercepat kecepatan reaksi karena.. a.

Di antara reaksi berikut yang mempunyai laju reaksi palin...
Reaksi berikut yang mempunyai laju reaksi paling cepat adalah.. soal ini ditanyakan manakah keadaan yang memiliki laju reaksi yang paling cepat Nah akhirnya akan kita Jelaskan mengenai faktor yang mempengaruhi laju reaksi dan pertama adalah luas permukaan yang kedua adalah konsep kemudian temperatur serta katalis dengan teori tumbukan maka.

Soal Dan Jawaban Laju Reaksi Kimia Kelas Xi
Modul Mekanisme Reaksi. Kumpulan Soal Mudah, Sedang & Sukar. Untuk mempelajari berjalannya reaksi serta kinetikanya dengan lebih seksama kita perlu mengetahui mekanisme reaksinya. Mekanisme reaksi adalah tahap demi tahap atau sederetan langkah yang detail mengenai berjalannya suatu reaksi kimia.

Satuan Tetapan Laju Reaksi K Untuk Reaksi Orde 2 Adalah
Orde reaksi pada reaksi secara keseluruhan disebut seaagai orde reaksi total. Besarnya orde reaksi total adalah jumlah semua orde reaksi pereaksi. Sehingga, orde reaksi total (orde reaksi) pada reaksi tersebut di atas adalah m + n. Contoh beberapa reaksi dan rumus laju reaksinya. Persamaan Laju Reaksi dan Orde Reaksi - Contoh Soal dan Jawaban.

Berikut merupakan rumus laju reaksi dari beberapa percoba...
Dalam satu liter yang dimaksud sudah termasuk volume zat terlarut dan volume pelarutnya. Jadi, 1 mol zat terlarut apa pun yang terlarut di dalam 1 liter pelarut memiliki konsentrasi 1.0 mol per liter (mol/L). Molaritas laju reaksi juga dipengaruhi oleh beberapa faktor lainnya, yaitu suhu, volume, dan tekanan zat pelarut.

Perhatikan datadata percobaan berikut. Percobaan [H2]
Reaksi kimia dapat berlangsung atau tidak berlangsung dapat dijelaskan dengan menggunakan teori tumbukan. Tumbukan antar partikel akan menghasilkan reaksi apabila memiliki energi yang cukup serta arah tumbukan yang tepat (tumbukan efektif). Semakin banyak tumbukan efektif maka semakin cepat laju reaksinya. Contoh laju reaksi cepat dan lambat disajikan dalam tabel berikut.

Contoh Soal Laju Reaksi Dan Orde Reaksi Orde Reaksi 0 1 2 Nol Satu Dua, Negatif, Persamaan
Pertanyaan. Reaksi berikut yang mempunyai laju reaksi paling cepat adalah.. 3 gram bongkahan + larutan HCI 0,01 M. 3 gram bongkahan + larutan HCI 0,1 M. 3 gram serbuk + larutan HCI 0,1 M. 3 gram serbuk + larutan HCI 0,001 M. 3 gram serbuk + larutan HCI 0,01 M. Iklan. MR.

Soal Dan Pembahasan Laju Reaksi Kelaz 11
Laju Reaksi. Faktor-Faktor yang Mempengaruhi Laju Reaksi. Diantara reaksi berikut yang terjadi paling cepat adalah.. A. 2 gram batang Zn dengan larutan HCl 0,01 M B. 2 gram batang Zn dengan larutan HCl 0,1 M C. 2 gram serbuk Zn dengan larutan HCl 0,01 M D. 2 gram serbuk Zn dengan larutan HCl 0,001 M E. 2 gram serbuk Zn dengan larutan HCl 0,1 M.

Di antara reaksiberikut ini yang mempunyai laju reaksi pa...
Pada soal yang menjadi variabel bebas (pembeda) adalah luas permukaan dan konsentrasi. Semakin luas permukaannya dan semakin besar konsentrasinya, maka laju reaksi akan semakin cepat. Pada opsi jawaban, bentuk luas permukaan terbesar adalah serbuk dan konsentrasi terbesar adalah 0,1 M. Jadi, jawaban yang benar adalah C.

Reaksi berikut yang mempunyai laju reaksi paling cepat ad...
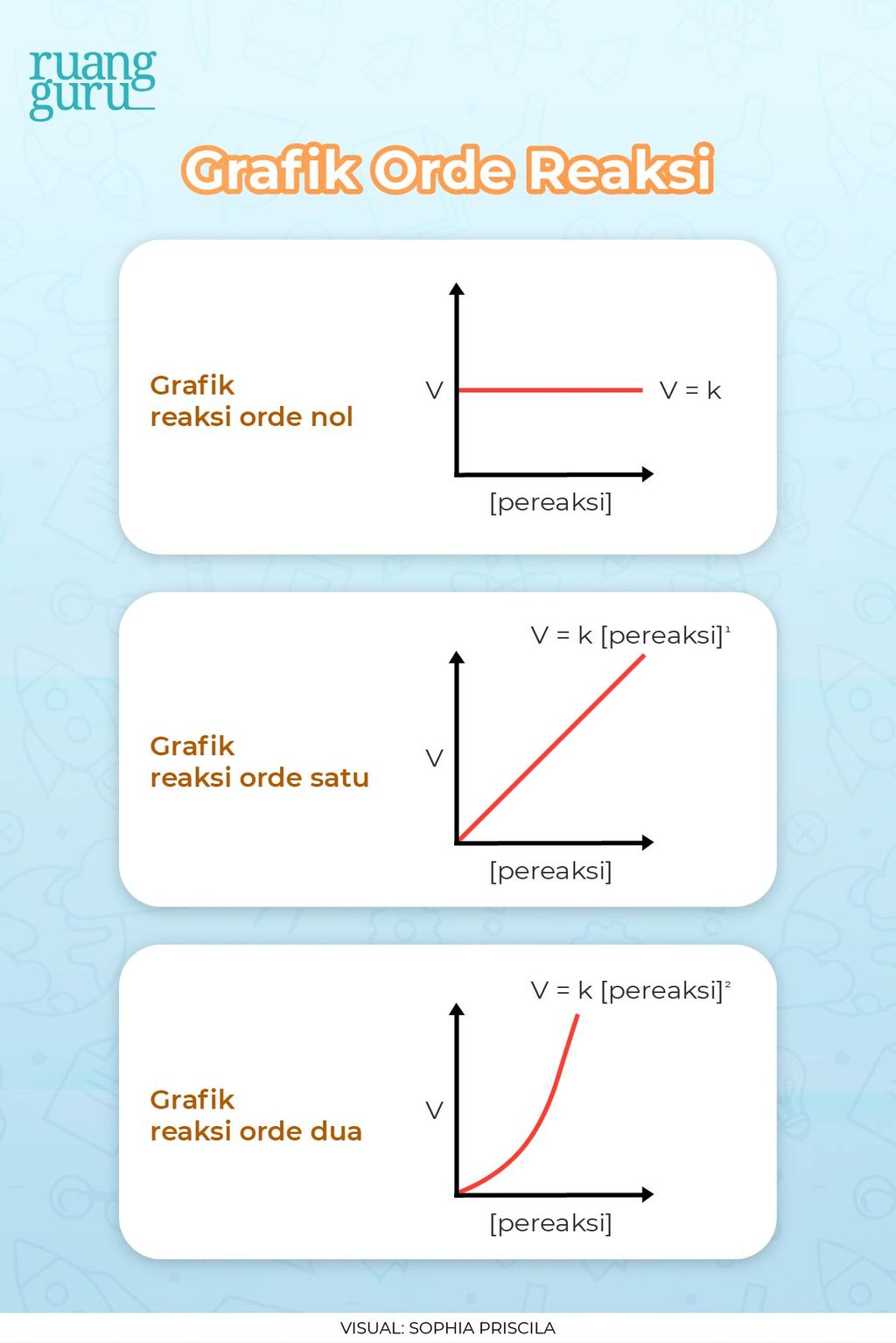
Grafik ini menunjukkan bahwa laju reaksi tidak bergantung pada konsentrasi reaksi. Baca juga: Sifat-Sifat Koloid dan Cara Pembuatannya. Pada grafik orde satu, laju reaksi itu punya perbandingan yang lurus dengan konsentrasi pereaksi. Kalau konsentrasi tersebut dinaikkan dua kali, maka laju reaksi juga akan dua kali lebih cepat dari awalnya.
Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11
Dibaca Normal 4 menit. Berikut ini rangkuman materi tentang konsep laju reaksi rumus dan contoh soalnya. tirto.id - Laju reaksi adalah laju berkurangnya kosentrasi pereaksi atau laju bertambahnya konsentrasi hasil reaksi tiap satuan waktu. Secara sederhana, laju reaksi diartikan sebagai perubahan konsentrasi pereaksi (reaktan) atau reaksi.