
Soal Dan Pembahasan Reaksi Redoks Dan Elektrokimia
Menurut Harahap (2016) sel volta adalah suatu sel elektrokimia yang dapat menghasilkan tegangan listrik yang disebabkan oleh reaksi reduksi dan oksidasi yang terjadi secara spontan. Pada sel volta.

Reaksi spontan/tidak spontan atau berlangsung/tidak berlangsung menggunakan data E°sel YouTube
Homepage / Elektrolisis / Reaksi Berikut yang Berlangsung Tidak Spontan Adalah:. Reaksi elektrokimia adalah contoh lain dari reaksi non-spontan yang penting untuk diketahui. Reaksi ini melibatkan aliran elektron antara zat-zat reaktan yang terhubung melalui sirkuit.. Reaksi yang berlangsung tidak spontan dapat terjadi melalui beberapa.

Reaksi Redoks dan Elektrokimia Kimia Kelas 12 • Part 3 Penyetaraan Reaksi Metode Setengah
Perkakas. < Subjek:Kimia. Elektrokimia adalah reaksi redoks yang bersangkut paut dengan listrik. Reaksi elektrokimia dibagi menjadi 2, yaitu: Sel galvani/sel volta adalah reaksi redoks yang menghasilkan listrik. Contohnya baterai. Sel elektrolisis adalah listrik yang mengakibatkan reaksi redoks. Contohnya adalah pemurnian logam dan pelapisan logam.

Diagram sel Volta, Potensial Sel,dan Reaksi Sel (ELEKTROKIMIA) KIMIA SMA YouTube
Reaksi elektrokimia berikut yang dapat berlangsung secara. Kimia. Kimia Fisik dan Analisis Kelas 12 SMA. Reaksi Redoks dan Sel Elektrokimia. Sel Volta dan Potensial Sel.

Proses Terjadinya Korosi merupakan proses atau reaksi elektrokimia
Pembahasan. Reaksi berlangsung secara spontan jika nilai potensial sel adalah positif. Pada sel volta, katode adalah tempat berlangsungnya reaksi reduksi, sedangkan anode adalah tempat berlangsungnya reaksi oksidasi. Berdasarkan data potensial reduksi sel, maka dapat diketahui:

Elektrokimia Reaksi Spontan dan Tidak Spontan YouTube
Notasi sel elektrolisis reaksi yang dapat berlangsung adalah metode yang digunakan untuk menggambarkan reaksi kimia yang terjadi selama proses elektrolisis. Proses elektrolisis melibatkan penggunaan arus listrik untuk menghasilkan reaksi kimia non-spontan di dalam sel elektrolisis. Saat arus listrik mengalir melalui elektrolit, reaksi redoks.

Bab 2 reaksi redoks dan elektrokimia
Reaksi Redoks dan Sel Elektrokimia;. Halo Fans kali ini kita akan membahas soal mengenai sel volta pada soal ini tanya adalah reaksi yang tidak dapat berlangsung dalam keadaan standar untuk mengerjakan soal ini kita perlu mengetahui tentang sel volta.. itu deret volta deret volta adalah susunan unsur-unsur berdasarkan potensial elektrode.

Reaksi Kimia Berikut Yang Sudah Setara Adalah
Baterai asam-timbal. Elektrokimia adalah cabang ilmu kimia fisik yang mempelajari aspek kelistrikan dari reaksi kimia. Elemen yang digunakan dalam reaksi elektrokimia dikarakterisasikan dengan banyaknya elektron yang dimiliki. Secara umum elektrokimia terbagi dalam dua kelompok, yaitu sel galvani dan sel elektrolisis.Reaksi elektrokimia dapat berlangsung secara spontan, yaitu ketika dua.

Bab 2 Reaksi Redoks dan Elektrokimia 2 Reaksi
A. Pengertian Elektrokimia. Elektrokimia merupakan reaksi yang mengubah reaksi kimia dan menghasilkan energy listrik atau sebaliknya. Pengubahan energi kimia menjadi energi listrik dapat berlangsung dalam sebuah sel volta berlangsung secara proses spontan, sebaliknya dalam sel elektrolisis merupakan proses tak spontan.
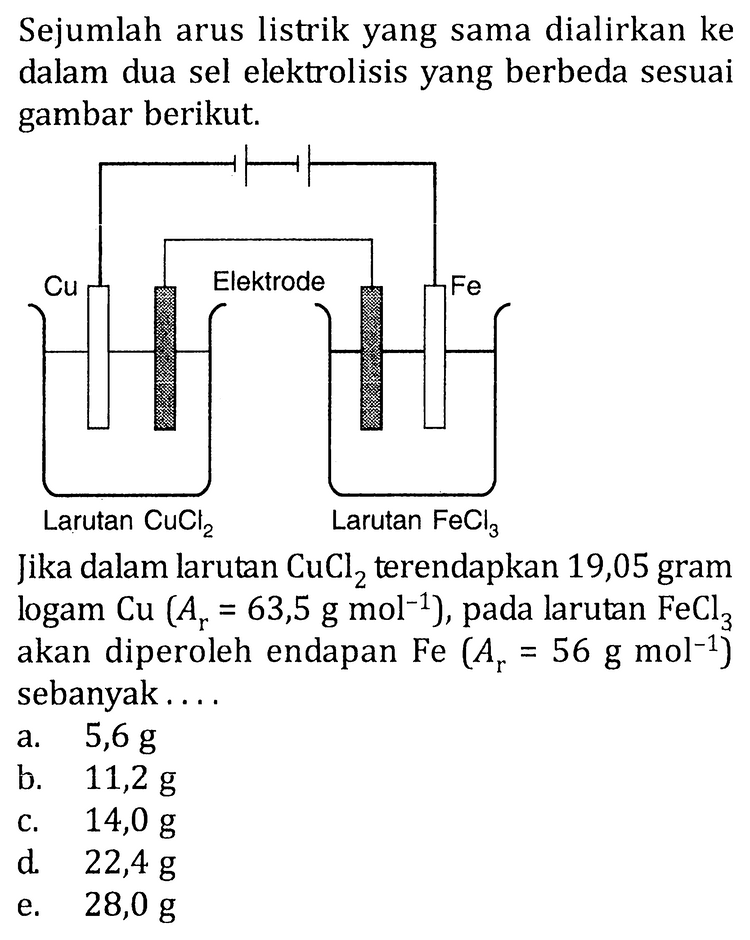
Kumpulan Contoh Soal Reaksi Redoks dan Sel Elektrokimia Kimia Kelas 12 CoLearn halaman 56
Elektrokimia merupakan cabang ilmu kimia yang mempelajari tentang interaksi antara reaksi kimia dengan arus listrik. Dalam elektrokimia, reaksi redoks (reduksi-oksidasi) dapat terjadi dengan bantuan aliran elektron yang melewati suatu sistem elektrokimia. Konsep elektrokimia telah memberikan kontribusi besar dalam berbagai bidang, termasuk.

Elektrokimia Pengertian, Jenis, Aplikasi dan Contohnya
Reaksi ini melibatkan pembuatan atau penggunaan listrik selama reaksi berlangsung. Meskipun reaksi elektrokimia biasanya berlangsung tanpa gangguan, ada beberapa jenis reaksi elektrokimia yang tidak dapat terjadi. Dalam artikel ini, kita akan membahas lebih lanjut tentang reaksi elektrokimia berikut yang tidak dapat berlangsung. 7 Paragraf.

Reaksi yang tidak dapat berlangsung dalam keadaan standar...
Sel elektrokimia adalah tempat terjadinya reaksi elektrokimia atau reaksi perpindahan elektron yang diakibatkan arus listrik atau menghasilkan arus listrik. Dilansir dari Encyclopedia Britannica , reaksi elektrokimia pertama kali dipelajari pada tahun 1796 oleh seorang ilmuan asal Italia bernama Alessandro Volta.

Reaksi berikut yang tidak berlangsung spontan adalah....
Reaksi elektrolisis larutan encer dengan elektrode grafit. Hasil elektrolisisnya adalah gas oksigen di anode dan gas hidrogen di katode. 2. Reaksi elektrolisis larutan dengan elektrode tembaga. Oleh karena anodenya dari Cu (anode reaktif), maka anode tersebut mengalami oksidasi dan hasilnya adalah ion di anode dan gas hidrogen di katode. Nah.
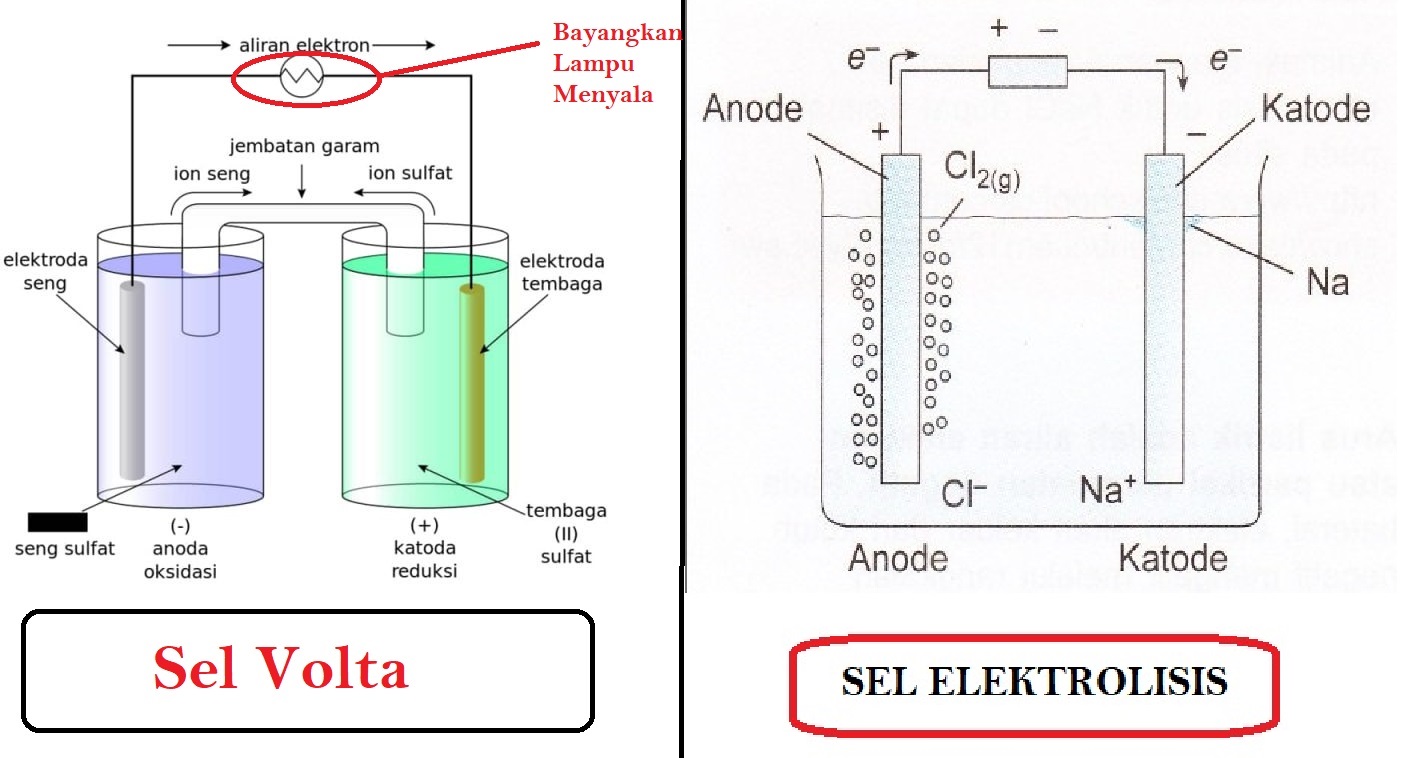
Kelas XII (KIMIA) Elektrokimia Konsep Dan Sel Volta (Part 1) Kirius Ilmu
Secara teoritis, sel elektrolisis merupakan bagian dari sel elektrokimia, di mana energi listrik digunakan untuk menjalankan reaksi redoks tidak spontan. Secara umum, sel elektrolisis tersusun dari: - Elektrolit, yaitu zat yang dapat menghantarkan listrik. - Sumber listrik yang menyuplai arus searah ( Direct Current = DC), misalnya baterai.

Reaksi yang dapat berlangsung spontan atau tidak berdasarkan Potensial reduksiE°sel kimia YouTube
Sel elektrolisis adalah sel elektrokimia di mana energi listrik digunakan untuk menjalankan reaksi redoks tidak spontan. Reaksi elektrolisis dapat didefinisikan sebagai reaksi peruraian zat dengan menggunakan arus listrik. Prinsip kerja sel elektrolisis adalah menghubungkan kutub negatif dari sumber arus searah ke katode dan kutub positif ke anode sehingga terjadi overpotensial yang.

Reaksi Redoks dan Elektrokimia Kimia Kelas 12 • Part 7 Sel Volta YouTube
Logam Ag merupakan logam bebas (atomik) yang tidak dapat mendesak unsur H 2. Berdasarkan deret volta logam Ag berada di sebelah kanan unsur H sehingga reaksi ini tidak dapat berlangsung spontan. Jadi, kedua reaksi di atas tidak dapat berlangsung dalam kondisi standart atau spontan.