
Metode IE/SR, Penyetaraan 32 KMnO4 + H2SO4 + H2C2O4 → MnSO4 + K2SO4 + H2O + CO2 (Asam) YouTube
Penyetaraan reaksi redoks molekuler dengan metode aljabar dan metode setengah reaksi: CuSO4 + KSCN + H2SO4 + H2O → CuCN + K2SO4 + H2SO3. -basa Autocorrect Bedah Kisi-kisi Soal UN Kimia 2019 Bentuk Molekul Bilangan Oksidasi Chemsketch Elektrolisis Gaya Antarmolekul Hidrolisis Garam Hukum Dasar Kimia Ikatan Kimia kalkulator kimia Kelarutan.

LENGKAP UNTUK PEMULA ‼️ HIDROLISIS GARAM PART2 ‼️ CARA MENULISKAN REAKSI HIDROLISIS YouTube
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Tuliskan reaksi hidrolis.

Reaksi redoks KMnO4 (aq) +K2C2O4 (aq) +H2SO4 (aq) > K...
K2SO4 + H2O = KOH + H2SO4 is a Double Displacement (Metathesis) reaction where one mole of aqueous Potassium Sulfate [K 2 SO 4] and two moles of liquid Water [H 2 O] react to form two moles of aqueous Potassium Hydroxide [KOH] and one mole of aqueous Sulfuric Acid [H 2 SO 4] Show Chemical Structure Image.

Pasangan persamaan reaksi hidrolisis yang bersifat basa adalah Universityku
Pembahasan : Hidrolisis yang berasal dari asam lemah dan basa lemah merupakan hidrolisis total, sebab kedua ion garam mengalami reaksi hidrolisis dengan air. Dari soal diatas penyusun dari garam NH 4 CN adalah NH 4 OH ( basa lemah ) dan HCN ( asam lemah ) Dan akan terjadi hidrolisis total. Maka NH 4 CN akan terionisasi menjadi NH 4+ dan CN - .
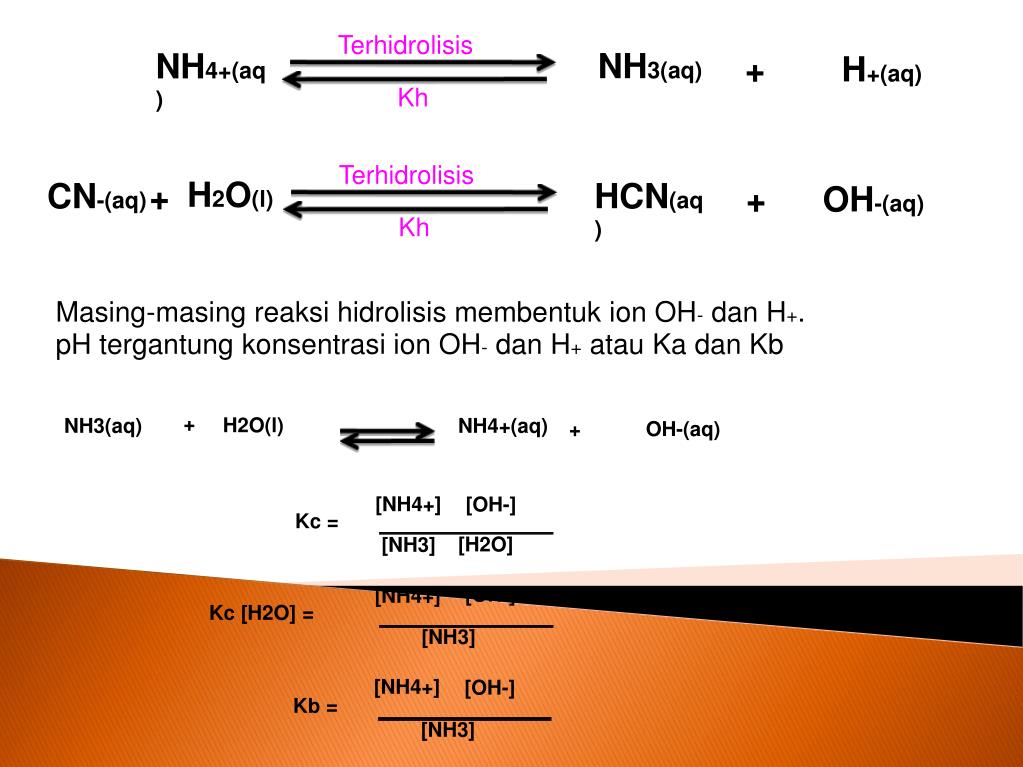
PPT Hidrolisis didefinisikan sebagai reaksi dengan air PowerPoint Presentation ID3918911
Step 4: Substitute Coefficients and Verify Result. Count the number of atoms of each element on each side of the equation and verify that all elements and electrons (if there are charges/ions) are balanced. 2 KMnO4 + 3 H2SO4 + 10 HCl = K2SO4 + 2 MnSO4 + 5 Cl2 + 8 H2O. Reactants.

Perhatikan Tabel Persamaan Reaksi Hidrolisis Garam Riset
Hidrolisis - Kimia Kelas 11 - Teori, Jenis Reaksi, dan Contoh Soal. by sereliciouz & Andjar Tyassih, S.Si. Agustus 28, 2019. Dalam artikel ini akan dibahas secara detail tentang teori dan reaksi hidrolisis, jenis-jenis reaksi hidrolisis, contoh soal dan pembahasan reaksi hidrolisis, dan aplikasi reaksi hidrolisis dalam kehidupan sehari-hari.

Suatu reaksi hidrolisis garam formiat digambarkan sebagai...
H2O2 + 2KI + H2SO4 = I2 + K2SO4 + 2H2O is a redox reaction where I is oxidized and O is reduced. KI is a reducing agent (i.e. it lost electrons) and H 2 O 2 is a oxidizing agent (i.e. it gained electrons). Enter a redox reaction equation to balance it and calculate the reducing and oxidizing agents. Use uppercase for the first character in the.

Hidrolisis Pengertian Jenis Jenis Reaksi Dan Contoh Soal Dengan Sexiz Pix
Reaksi ion tersebut dengan air disebut hidrolisis. Contoh NH 4 + + H 2 O → NH 4 OH + H + Ion-ion yang berasal dari asam kuat misalnya Cl -, NO 3 -, SO 4 2-atau ion-ion yang berasal dari basa kuat misalnya Na +, K +, Ca 2+ tidak bereaksi dengan air sehingga tidak terjadi hidrolisis. Jenis hidrolisis garam. Hidrolisis garam dari asam lemah.
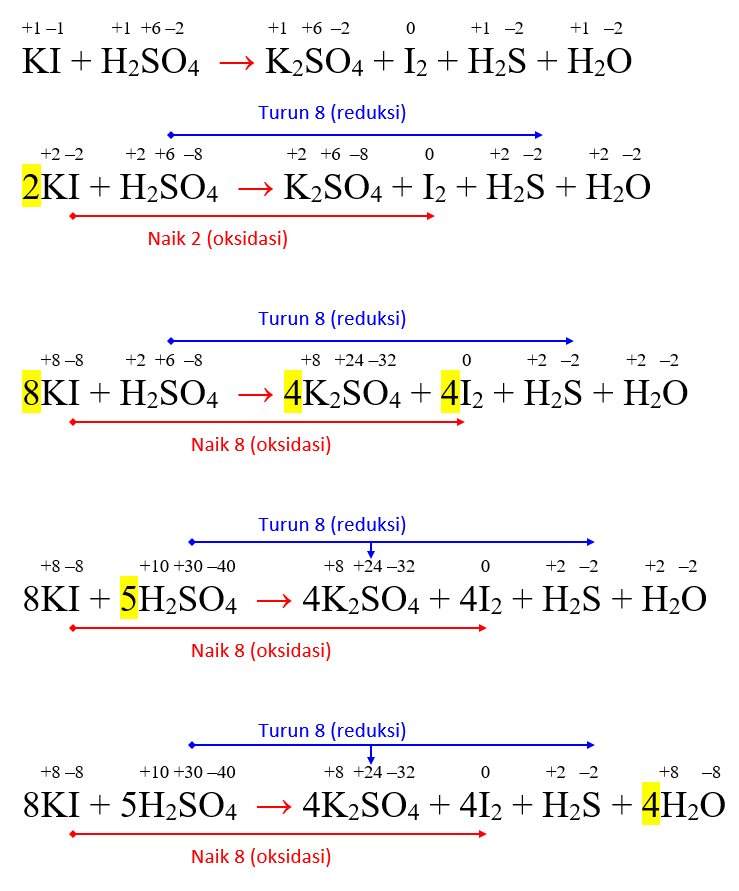
Penyetaraan Reaksi Redoks KI + H2SO4 → K2SO4 + I2 + H2S + H2O Markas Belajar
Hidrolisis berasal dari bahasa Yunani "hydro" yang berarti air dan "lysis" yang berarti lepas atau penguraian. Hidrolisis garam dapat diartikan sebagai reaksi reversible penguraian garam oleh air. Sehingga, hidrolisis garam adalah reaksi antara salah satu ion-ion garam (kation atau anion) dengan air dan membentuk larutan bersifat asam.
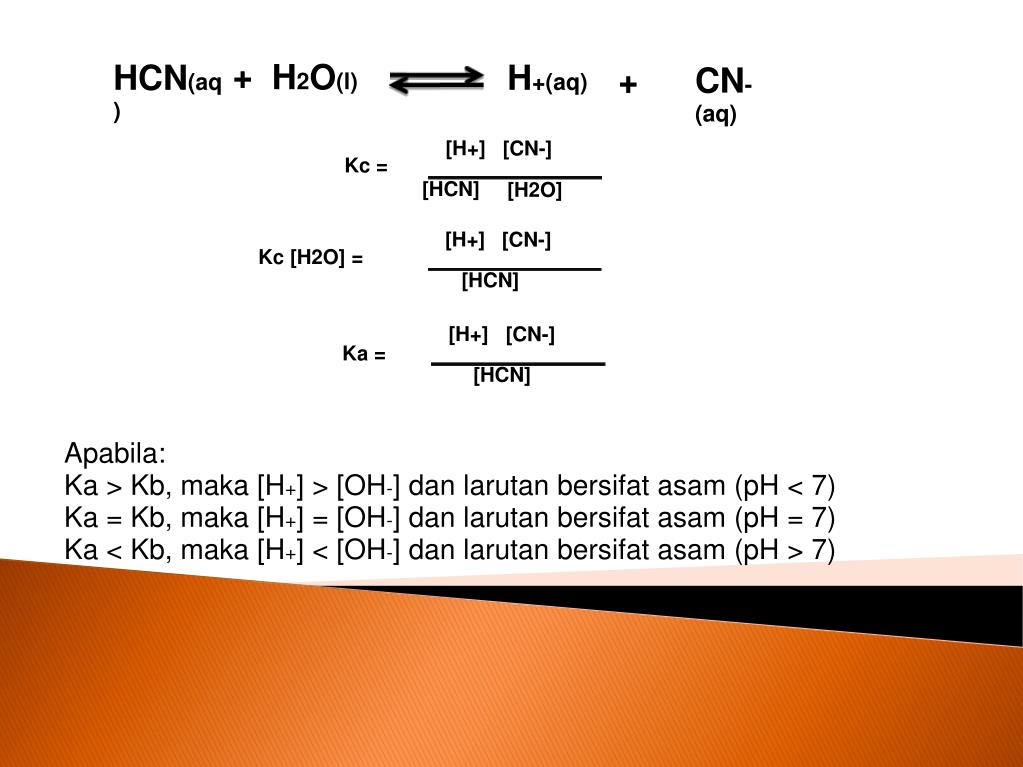
PPT Hidrolisis didefinisikan sebagai reaksi dengan air PowerPoint Presentation ID3918911
Tuliskan reaksi hidrolisis garam dan memprediksi sifatnya. Perhatikan data hidrolisis beberapa larutan garam berikut. Perhatikan reaksi ionisasi dan hidrolisis dari senyawa N. Tuliskan persamaan reaksi penetralan berikut. (a) Larutan. Di antara larutan berikut yang dapat bereaksi dengan H_ (. Tuliskan persamaan reaksi penetralan berikut.

Penyetaraan reaksi redoks K2CrO4 + H2SO4 + FeSO4→ K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O metode PBO
Reaksi hidrolisis K2SO4 adalah sebuah proses penting dalam kimia anorganik yang dapat menghasilkan pH asam atau basa tergantung pada keadaan lingkungan. Dalam reaksi ini, K2SO4 dipecah menjadi ion-ion K+ dan SO4²-, merespon dengan air dan menghasilkan ion hidroksida (OH-) atau ion hydronium (H+), yang pada akhirnya akan menentukan apakah lingkungan akan bersifat asam atau basa.
KI + H2SO4 menjadi K2SO4 +I2 +H2S + H20, setarakn
Setarakan jumlah muatan dengan menambahkan sejumlah e - pada ruas yang lebih positif. 2KI + H2SO4 → K2SO4 + I2 + 2H+ + 2e-. H2SO4 + 8H+ + 8e- → H2S + 4H2O. Seimbangkan jumlah elektron yang dilepas dengan yang diterima dengan mengali-lipatkan dengan angka tertentu untuk semua spesi pada reaksi yang perlu dikali-lipatkan.

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
Pada reaksi elektrolisis K2SO4, terjadi oksidasi dan reduksi. Oksidasi terjadi pada anoda, di mana ion sulfat (SO4 2-) dioksidasikan menjadi oksigen (O2) dan ion sulfat (SO4 2-). Reduksi terjadi pada katoda, di mana ion kalium (K+) direduksi menjadi kalium (K) dan ion kalium hidroksida (KOH).

Detail Contoh Reaksi Hidrolisis Koleksi Nomer 45
Word Equation. Potassium Bromide + Sulfuric Acid = Potassium Sulfate + Hydrogen Bromide. KBr + H2SO4 = K2SO4 + HBr is a Double Displacement (Metathesis) reaction where two moles of aqueous Potassium Bromide [KBr] and one mole of aqueous Sulfuric Acid [H 2 SO 4] react to form one mole of aqueous Potassium Sulfate [K 2 SO 4] and two moles of aqueous Hydrogen Bromide [HBr]
pada reaksi redoksKMnO4 + H2SO4 + KNO3 →K2SO4 + H...
H2SO4 + KOH = K2SO4 + H2O is a Double Displacement (Metathesis) reaction where one mole of aqueous Sulfuric Acid [H 2 SO 4] and two moles of aqueous Potassium Hydroxide [KOH] react to form one mole of aqueous Potassium Sulfate [K 2 SO 4] and two moles of liquid Water [H 2 O] Show Chemical Structure Image.

Diketahui reaksi KMnO4 + H2SO4 + H2C2O4 → K2SO4
Persamaan reaksinya adalah: (NH4)2SO4 → 2NH4+ + SO42- NH4+ + H2O → NH4OH + H+ Hidrolisis garam adalah reaksi dari sisa ion asam atau basa lemah dengan air. Dimana pH masing-masing larutan tergantung dari sifat senyawa yang terlarut dalam airnya. Hidrolisis garam terdapat 4 macam, yaitu garam dari asam dan basa kuat (tidak terhidrolisis.