
Mengenal Bunyi Hukum Faraday Kimia Kelas 12
Rumus Faraday 2 adalah rumus penting dalam bidang elektrokimia yang digunakan untuk menghitung muatan listrik total dalam suatu reaksi elektrokimia. Dengan menggunakan rumus ini, kita dapat mengkalkulasi hasil reaksi elektrokimia dengan akurat dan memperoleh data yang berguna dalam berbagai aplikasi teknologi dan industri.

Terakurat 34+ Rumus Faraday
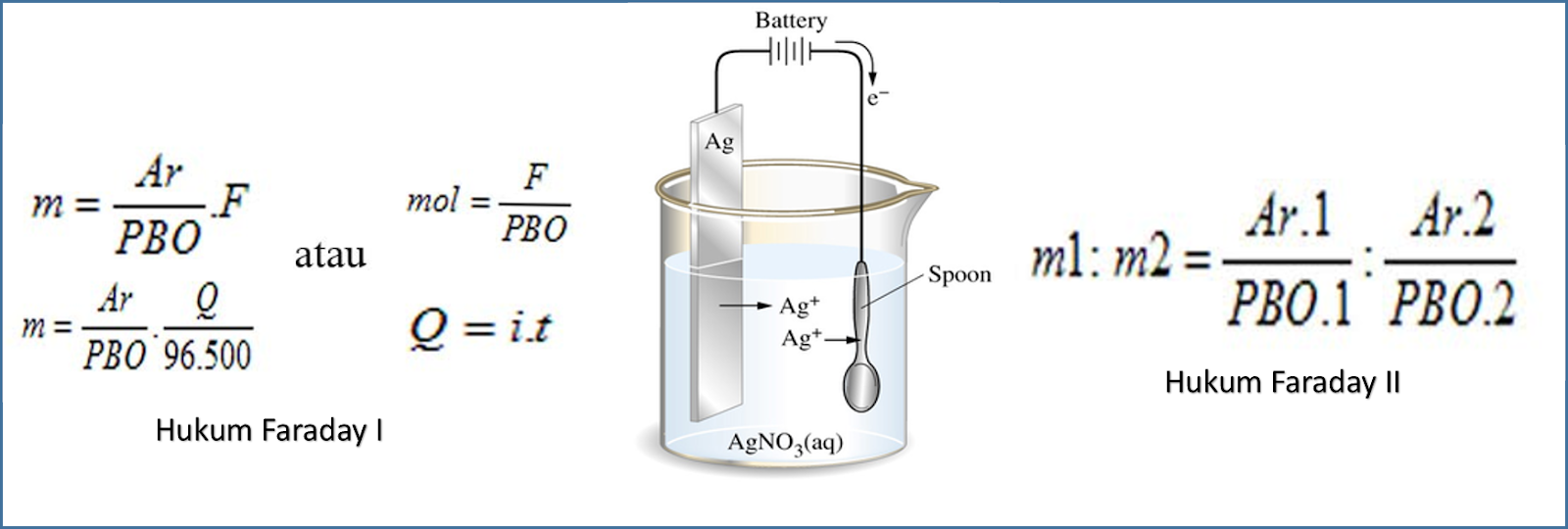
Rumus hukum Faraday 2. W1 / W2 = e1 / e2. Keterangan: W1 adalah massa zat 1 (gram) W2 adalah massa zat 2 (gram) e1 adalah massa ekuivalen zat 1. e2 adalah massa ekuivalen zat 2. Dari penjelasan di atas, pada dasarnya hukum Faraday digunakan untuk memperhitungkan aspek kuantitatif zat-zat yang terlibat dalam reaksi dalam sel elektrolisis.

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Rumus Hukum Faraday 2 dapat dinyatakan sebagai berikut: M = E * F * n. Dimana: M = massa zat yang terbentuk selama elektrolisis (gram) E = ekuivalen massa zat (gram/Coulomb) F = konstanta Faraday ≈ 96,485 Coulomb/mol (muatan per mol elektron) n = jumlah mol zat yang berpartisipasi dalam reaksi redoks.

Foto Hukum Faraday I dan II tentang Elektrolisis
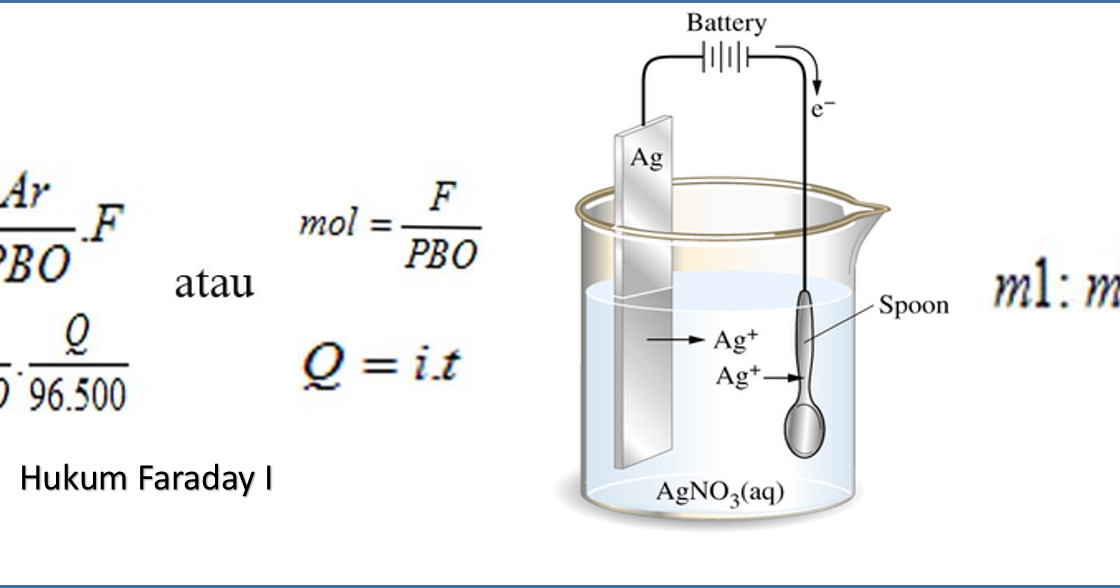
Adapun rumus hukum Faraday 1 dan 2 adalah sebagai berikut. Rumus Hukum Faraday 1. Ingat, bunyi hukum Faraday 1: "Massa zat yang dilepaskan selama elektrolisis berbanding lurus dengan jumlah listrik yang digunakan" Berdasarkan bunyinya, rumus hukum Faraday 1 dapat dituliskan sebagai berikut. G ≈ Q atau G ≈ it. Keterangan:

Rumus Praktis Hukum Faraday Pojok Kimia
Rumus hukum Faraday 2 atau Faraday's law of electromagnetic induction adalah rumus matematika yang menjelaskan hubungan antara perubahan medan magnet dengan arus listrik yang dihasilkan. Rumus ini merupakan pengembangan dari hukum Faraday yang pertama, yang mengatakan bahwa arus listrik akan dihasilkan oleh sebuah konduktor yang berada dalam.
Hukum Faraday Semua Ada
Rumus hukum Faraday II adalah W1 / W2 = e1 / e3, W1 adalah massa zat 1 (gram), W2 adalah massa zat 2 (gram), ei adalah ekuivalen zat 1 dan e2 adalah ekuivalen zat 2. Penjelasan ini menegaskan jika memang adanya penerapan hukum ini dipakai untuk memperhitungkan aspek kuantitatif zat-zat yang terlibat dalam reaksi di dalam sel elektrolisis.

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Bunyi Hukum Faraday 1 dan 2, Beserta Rumus Faraday. Bunyi Hukum Faraday - Pengertian Hukum Faraday adalah salah satu hukum yang menyatakan bahwa hubungan antara jumlah listrik yang dipakai dengan Massa Zat yang dihasilkan pada proses Elektrolisis baik di Katoda maupun Anoda, dan Teori Faraday ini sering disebut juga dengan Teori Kuantitatif.

√ Materi Hukum Faraday Bunyi, Rumus, Contoh Soal
Michael Faraday, ia adalah seorang ilmuan asal Inggris yang lahir pada 22 September 1791 di Newington Butts, Inggris. Kemudian ia dijuluki sebagai "bapak listrik", berkat usahanya listrik bisa jadi teknologi yang memiliki banyak kegunaan. Michael Faraday menjadi seorang ahli kimia dan fisika berkat mempelajari aspek kuantitatif dan.

Hukum Faraday 2 Elektrolisis Seri Kimia SMA Kelas 3 YouTube
t : Waktu (secon). F : Tetapan Faraday = 96.500 Coulomb/mol. 𝑄=𝑖×𝑡. Contoh soal penerapan Hukum Faraday 1 adalah sebagai berikut ini: 1.Tentukan Jumlah faraday untuk mereduksi ion Ca2+ dalam bentuk leburan (Ar Ca= 40) sebanyak 12 gram. Penyelesaian : Diketahui : W = 12 gram. Ar Ca = 40.

Pengertian Hukum Faraday Dilengkapi Bunyi Rumus Dan Contoh Soal Riset
Rumus hukum faraday 2 berbeda dengan rumus hukum faraday 1 sebab di sini ada massa ekuivalen dengan satuan ME dan juga massa zat dengan satuan w. Massa ekuivalen ini adalah hasil perhitungan massa atom relatif atau Ar yang dibagi dengan perubahan muatan ion atau bilangan oksidasinya. Jika ditulis dengan rumus maka akan menjadi:

PPT HUKUM INDUKSI FARADAY PowerPoint Presentation, free download ID5738336
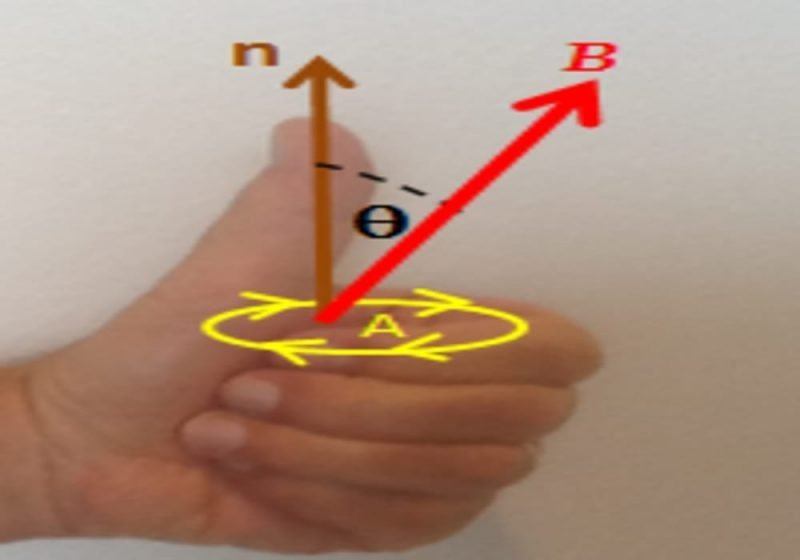
Rumus Hukum Faraday 1 Dan 2. Dalam sebuah Hukum Faraday, secara matematis perhitungan arus listrik dapat dirumuskan menjadi: Rumus Hukum Faraday untuk menghitung suatu gaya gerak listrik maka, rumus yang digunakan secara sistematis ialah sebagai berikut: ɛ = -N (ΔΦ / ∆t) Keterangan: ɛ ialah gaya gerak listrik (ggl) induksi (volt)
Hukum Faraday Hukum Induksi Faraday Rumus, Soal, Jawaban
Perbandingan ini menjadi persamaan dengan penambahan faktor 1/96.500, sehingga diperoleh rumus hukum faraday: w = 1/96.500 x I x t x ME. dengan, Contoh soal Hukum Faraday . Arus listrik 0,2 ampere dilewatkan selama 50 menit ke dalam sel elektrolisis yang mengandung larutan CuCl 2. Hitunglah endapan Cu yang terbentuk pada katode.
Hukum Faraday Pojok Kimia
Pengertian dan Bunyi hukum Faraday 1 dan 2☑️ Rumus (persamaan), Contoh Soal dan pembahasan hukum Faraday 1 dan 2 lengkap☑️ Seorang ilmuwan yang berasal dari Inggris bernama Michael Faraday menemukan sebuah hukum yang digunakan dalam ilmu kimia dinamakan Hukum Faraday. Hubungan antara penggunaan muatan listrik dan hasil massa zat dalam electrode dijelaskan melalui hukum ini.

Soal Hukum Faraday LEMBAR EDU
Belajar Modul, Rumus, & Soal Elektrolisis dan kuis interaktif.. Terdapa 2 Hukum Faraday Kimia yakni hukum faraday 1 dan hukum faraday 2, lebih lanjut seperti berikut: 1. Hukum Faraday I "Massa zat yang terjadi atau melarut selama proses electrolysis berbanding lurus dengan jumlah muatan listrik yang melalui sel elektrolisis kimia.

Hukum Faraday II kelas 12 IPA 2 (SMA DPA) YouTube
Jika rumus hukum Faraday 1 dan 2 ini digabungkan, maka akan diperoleh rumus baru, yaitu: G = k . i . t . ME. Keterangan: k = tetapan/faktor pembanding. Faraday menemukan bahwa harga faktor pembanding ini adalah 1/96.500, sehingga rumus di atas dapat dituliskan sebagai berikut. di mana : G = massa yang dihasilkan pada elektrolisis (gram) i.

Hukum Faraday II Tanpa Menghafal Rumus YouTube
Hukum Faraday: Bunyi, Rumus, & Contoh Soal. Oktober 2, 2023 Oleh Eka, S.Si. Hukum Faraday adalah ilmu yang mempelajari mengenai dasar elektromagnetisme yang merupakan proses perubahan kimia menghasilkan arus listrik maupun sebaliknya. Hukum ini dikemukakan oleh Michael Faraday, seorang ilmuwan asal Inggris yang bekerja dalam bidang elektrolisis.