
Contoh Soal Molaritas Dan Pembahasannya
Kalikan massa atom relatif dengan konstanta massa molar. Hasil perkaliannya didefinisikan sebagai 0,001 kilogram per mol atau 1 gram per mol. Ini mengubah satuan atom menjadi gram per mol dan membuat massa molar hidrogen menjadi 1,007 gram per mol, karbon 12,0107 gram per mol, oksigen 15,9994 gram per mol, dan klorin 35,453 gram per mol.
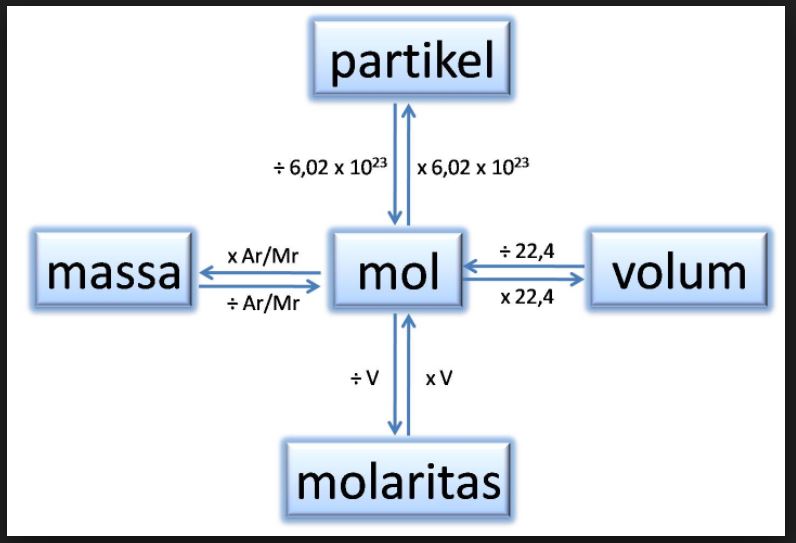
Hubungan Mol dengan Jumlah Partikel dan Massa Zat cekrisna
Mol (simbol: mol; bahasa Inggris dan Prancis: mole) adalah satuan pokok untuk besaran jumlah zat dalam Sistem Satuan Internasional (SI). Setelah redefinisi pada tahun 2019, definisi satuan mol, seperti yang disebutkan dalam Brosur SI edisi kesembilan, adalah sebagai berikut.. Mol, yang disimbolkan dengan mol, adalah satuan jumlah zat dalam SI. Satu mol mengandung persis 6,022140 76 × 10 23.

Latihan Soal Konsep Mol YouTube
Satuan Konsentrasi Larutan. Di bawah ini akan dijelaskan lebih lanjut tentang konsentrasi larutan beserta dengan cara menghitung konsentrasi larutan. 1. Molaritas (M) Molaritas dalam konsentrasi larutan dikenal dengan istilah konsentrasi molar atau molaritas dengan simbol yang dimiliki yaitu M. Molaritas digunakan untuk mendapatkan konsentrasi.

apa perbedaan molalitas dan molaritas Brainly.co.id
Molaritas adalah suatu besaran yang menunjukkan jumlah mol zat terlarut pada setiap satuan volume larutan. Molaritas dinyatakan dengan satuan molar ( M ) atau mol/liter. Rumus molaritas untuk (n) mol senyawa terlarut dalam ( V ) liter larutan adalah sebagai berikut :
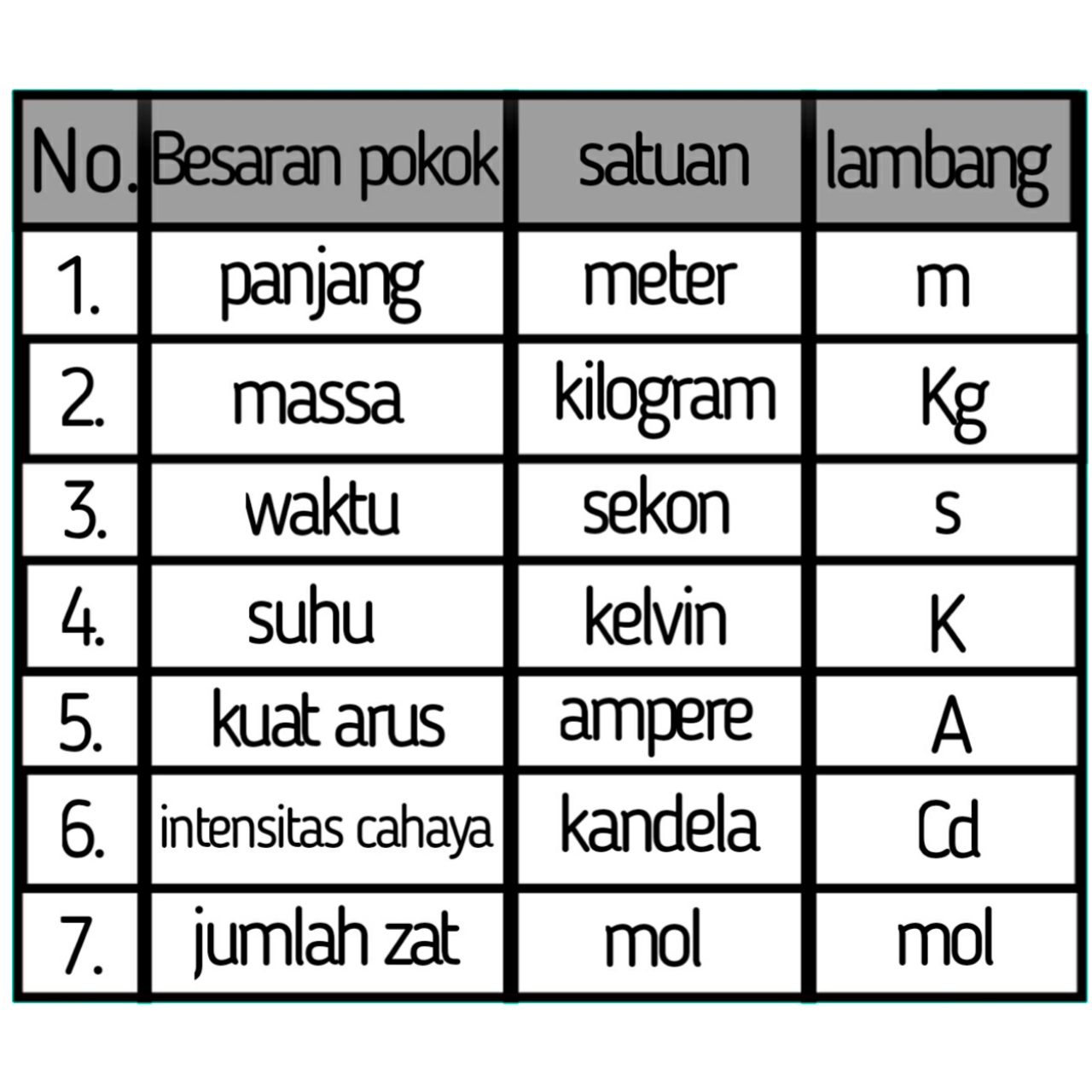
Pengertian besaran fisika dan sistem satuannya
Massa 1,5 mol C = 1,5 mol × 12 g mol-1 = 18 g. 3. Ar Fe = 56 sma, Jadi, massa molar Fe = 56 g mol-1. m = 9,3 × 1023 g. 4. Massa molar CO2 = 44 g mol-1. Jumlah molekul CO2 = 0,54× 1023 molekul. Demikianlah artikel tentang pengertian dan rumus massa molar (Mm), beserta contoh soal dan pembahasannya lengkap.

Konsep Mol Pada Kimia Rezfoods Resep Masakan Indonesia
Dalam bidang kimia ada beberapa satuan yang sering digunakan untuk menyatakan konsentrasi larutan ( banyaknya zat terlarut dalam sejumlah pelarut ). Beberapa satuan konsentrasi itu antara lain : mol, molalitas, molaritas, normalitas, ppm, persen massa, persen volum. Berikut akan saya jelaskan pengertian dan rumus dari satuan-satuan di atas : 1.

Amount of Substance in Relation to Volumes of Gases (3.5.1) AQA GCSE Chemistry Revision Notes
Mol/ccm adalah satuan kandungan molar. Mereka adalah mol/dm3 atau (diucapkan "molar") Kadang-kadang konsentrasi zat terlarut molar dapat disingkat dengan tanda kurung siku di sekitar rumus kimia. Misalnya, konsentrasi anion hidroksida dapat ditulis dalam [OH-]. Ada banyak unit yang berbeda dari larutan molar. mol per Liter (mol/l).

Contoh Soal Molaritas Beserta Pembahasan
Soal dan Jawaban Konsentrasi Larutan: Molaritas, Molalitas, Fraksi Mol, Persen Berat, Normalitas. 1. Konversi molal ke % massa. Contoh soal: Hitunglah % massa dari larutan NaI 0,2 molal (massa molar NaI = 150 g/mol) Penyelesaian: Arti 0,2 molal NaI adalah 0,2 mol NaI dalam 1 Kg pelarut air. massa NaI sebanyak 0,2 mol = 0,2 mol x 150 g/mol = 30 g.

Soal 3. Konversi satuan konsentrasi ppm ke molaritas YouTube
Satuan yang digunakan molaritas adalah mol/liter atau mmol/mL. Sementara rumus molalitas adalah: Keterangan: m = molalitas (mol/kg) Mr = massa molar zat terlarut (g/mol) massa = massa zat terlarut (g) p = massa zat terlarut (g) Adapun satuan yang digunakan dalam molalitas adalah m atau mol/kg. 3. Hal-hal yang mempengaruhi
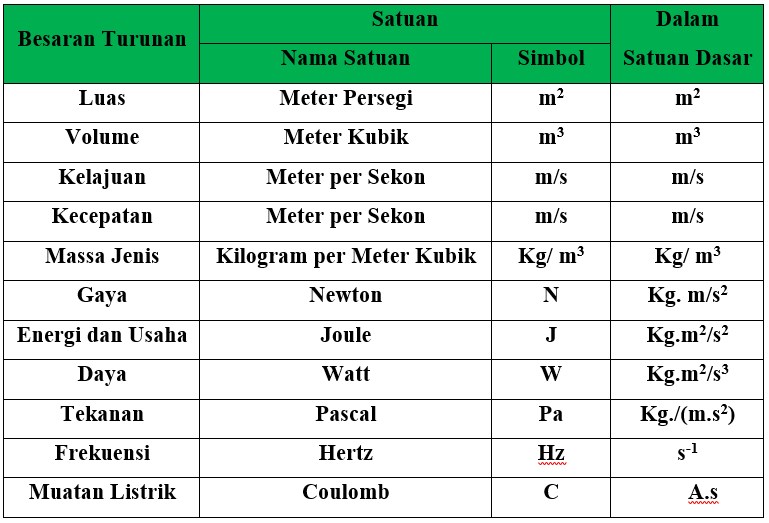
Satuan Dan Dimensi 7 Besaran Pokok Dalam Fisika Soal Fisika Matematika Riset
Kalau tadi molaritas memiliki satuan Molar (M), lain halnya dengan molalitas yang memiliki satuan molal (m). Dari sini sudah kelihatan belum perbedaan molaritas dan molalitas? Tenang, elo juga akan mengetahui rumus molalitas di poin selanjutnya. Tapi sebelum lanjut ke rumus molaritas larutan, gue saranin elo download aplikasi Zenius di gadget.

Cara Menghitung Massa Atom Relatif Ar Dan Massa Molekul Relatif Mr My XXX Hot Girl
Satuan molalitas. Molalitas adalah besaran turunan yang memiliki satuan. Dilansir dari ChemistryGod, satuan standar molalitas adalah mol per kilogram (mol/kg) atau kerap disebut sebagai molal. Molal biasanya dilambangkan dengan huruf "m". Misalnya, molalitas suatu larutan adalah 12 mol/kg, maka dapat dinyatakan sebagai 12 molal atau 12 m.

PPT KONSEP MOL PowerPoint Presentation, free download ID6336687
Contoh Soal Konsep Mol Beserta Jawabannya. 1. Sebanyak 4,9 gram H2SO4 H 2 SO 4 dilarutkan dalam air sehingga diperoleh 500 mL larutan. Tentukan jumlah ion yang yang terlarut dalam larutan dan tentukan konsentrasi ion H+ H +. Jawaban contoh soal konsep mol dan penyelesaiannya. nH2SO4 = m Mr = 4, 9 98 = 0, 05 mol n H 2 SO 4 = m M r = 4, 9 98 = 0.
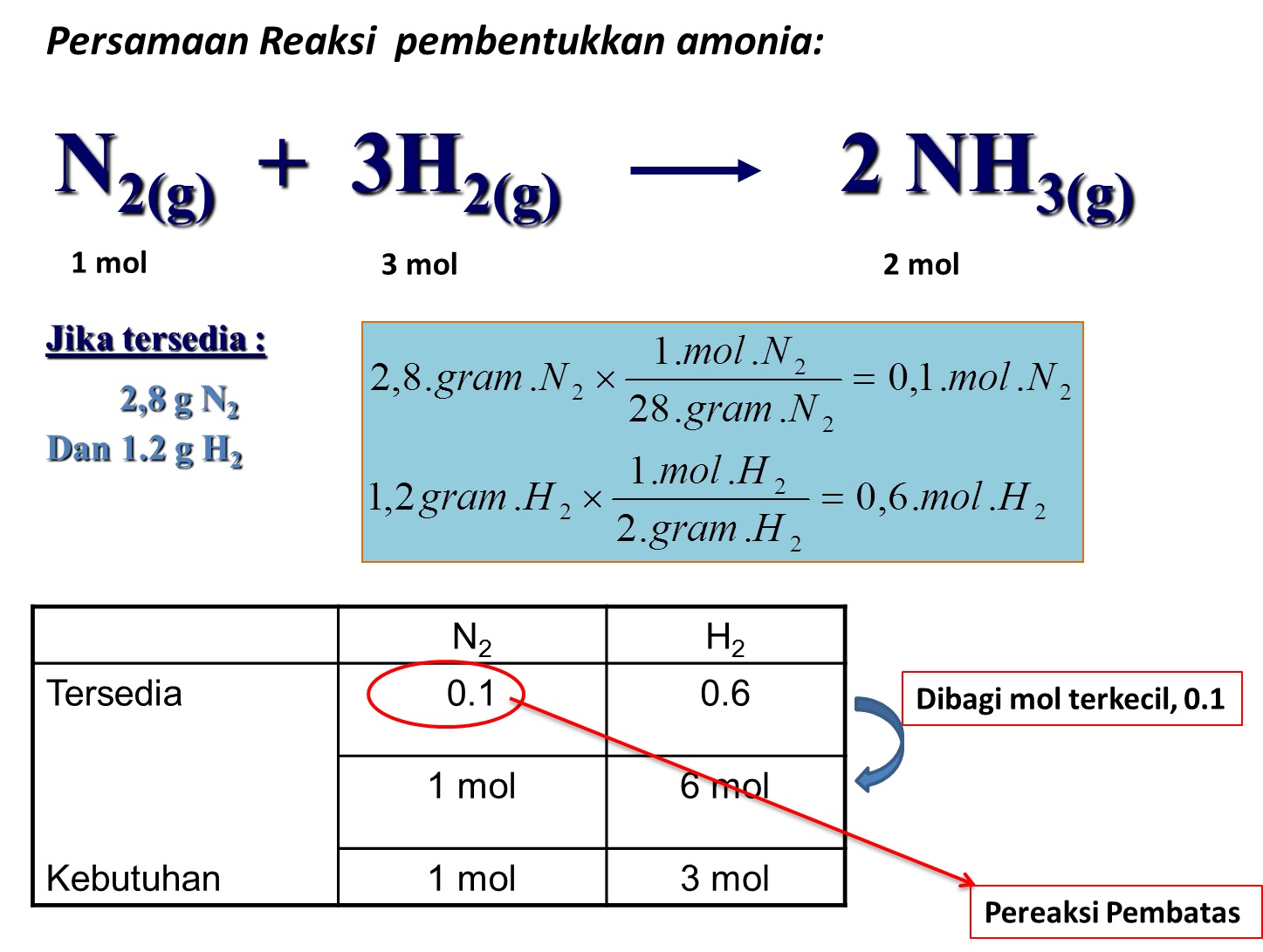
5 Tahapan Reaksi Kimia kabarmedia.github.io
As mass/volume = molarity × molar mass, then mass / (volume × molar mass) = molarity. Substitute the known values to calculate the molarity: molarity = 5 / (1.2 × 36.46) = 0.114 mol/l = 0.114 M. You can also use this molarity calculator to find the mass concentration or molar mass. Simply type in the remaining values and watch it do all the.

Tentukan Jumlah Mol Yang Terdapat Dalam 1 Juta Atom Besi
Molaritas (juga disebut konsentrasi molar, konsentrasi jumlah, atau konsentrasi zat) adalah ukuran konsentrasi dari spesies kimia, khususnya zat terlarut dalam larutan, dalam hal jumlah zat per satuan volume larutan. Dalam kimia, satuan molaritas yang paling umum digunakan adalah jumlah mol per liter, yang memiliki lambang satuan mol/L atau mol/dm 3 dalam satuan SI.

Mengubah satuan larutan dari persen massa menjadi molaritas YouTube
Molaritas yaitu besaran yang menyatakan jumlah mol zat terlarut pada tiap satuan volume larutan. Satuan molaritas ialah molar (M) yang sama dengan mol/liter. Jika terdapat n mol senyawa terlarut dalam V liter larutan, maka rumus molaritas larutan yaitu : M = n/V. Keterangan: M = molaritas suatu zat (mol/L) V = volume larutan (ml) gr = massa.

PPT Sifatsifat Fisis Larutan PowerPoint Presentation, free download ID5821209
In chemistry, the molar mass ( M) of a chemical compound is defined as the ratio between the mass and the amount of substance (measured in moles) of any sample of said compound. [1] The molar mass is a bulk, not molecular, property of a substance. The molar mass is an average of many instances of the compound, which often vary in mass due to.