
Penerapan Kenaikan Titik Didih Larutan Dalam Kehidupan Sehari Hari Reverasite
Sebanyak 1 mol H2SO4 dilarutkan dalam 1.000 gram air. Jik. Kimia. Kimia Fisik dan Analisis Kelas 12 SMA. Sifat Koligatif Larutan. Kenaikan Titik Didih. Sebanyak 1 mol H2SO4 dilarutkan dalam 1.000 gram air. Jika Kb air = 0,52 C/m dan terurai sempurna, titik didih larutan tersebut adalah. Kenaikan Titik Didih.

Percobaan titrasi antara 10 mL larutan H2SO4 dengan NaOH
Titik didih asam sulfat adalah suhu di mana asam sulfat mulai mendidih. Asam sulfat adalah senyawa kimia yang memiliki rumus H2SO4 dan digunakan dalam berbagai aplikasi industri, seperti pembuatan baterai, pupuk, dan bahan bakar.

Urutan Titik Didih Senyawa YouTube
H2SO4 adalah cairan kental tidak berwarna atau agak kuning dengan bau menyengat. Asam sulfat memiliki kepadatan 1,84 g / mL, titik didih 337 ° C, dan titik leleh 10 ° C. Asam sulfat "pekat" adalah 98% dalam air, dan merupakan bentuk yang paling stabil. Banyak konsentrasi lain, dengan nama berbeda, tersedia untuk berbagai keperluan.

Pengertian Titik Didih Larutan Dalam Ilmu Kimia LABORATORIUM SMK
A. Perbedaan dari titi didih, mendidih dan titik didih normal Titik didih adalah suhu (temperatur) dimana tekanan uap sebuah zat cair sama dengan tekanan external yang dialami oleh cairan. Titik didih suatu zat adalah suhu yang tekanan uap jenuhnya. HCl → H+ + Cl-, jumlah n = 2 H2SO4 → 2 H+ + SO42-, jumlah n = 3 H3PO4 → 3 H+ + PO43.

Cara menentukan titik didih paling tinggi Amenoma
Asam Sulfat memiliki titik lebur 10,31 derajat celcius dan titik didih pada 336,85 derajat celcius. Umumnya Asam sulfat dapat diproduksi dari belerang (S), pyrite (FeS), dan juga beberapa sulfida logam (Cu S, ZnS, NiS). Rumus kimia asam sulfat adalah H2SO4 terbentuk dari beberapa komponen, seperti kation asam (H+) dan anion sulfat (SO42-).
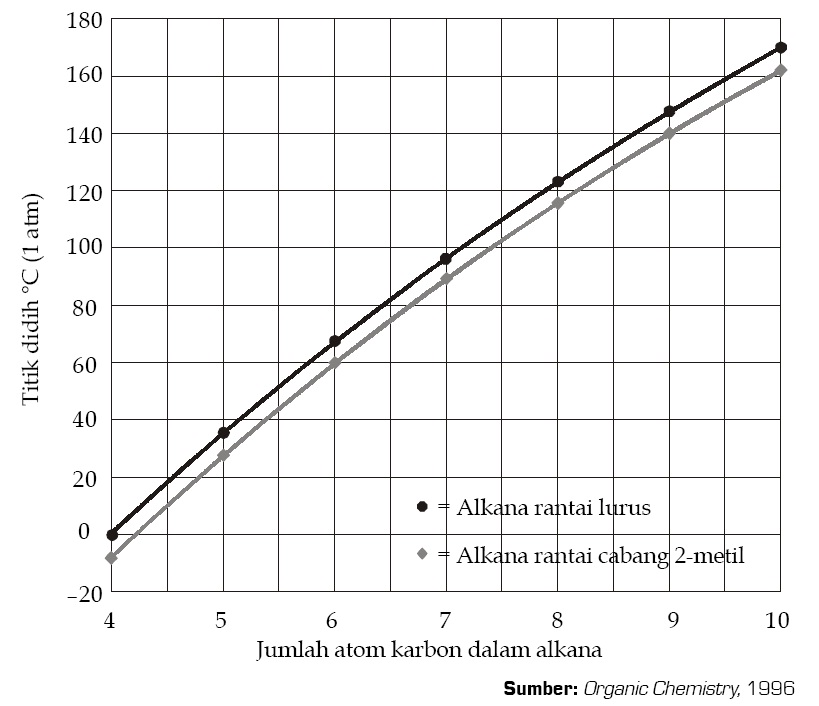
Pintar Pelajaran Titik Didih Dan Keisomeran Senyawa Hidrokarbon, Alkana, Alkena, Dan Alkuna
Asam sulfat, H. 2 SO. 4, merupakan asam mineral (anorganik) yang kuat. Zat ini larut dalam air pada semua perbandingan. Asam sulfat mempunyai banyak kegunaan dan merupakan salah satu produk utama industri kimia. Produksi dunia asam sulfat pada tahun 2001 adalah 165 juta ton, dengan nilai perdagangan seharga US$8 juta.

Diketahui data titik didih beberapa senyawa berikut. Seny...
Kenaikan Titik Didih. Larutan NaCl, KCl, MgSO4, K2SO4, dan H2SO4 masing-masing 0,1 m mempunyai faktor van't Hoff berturut-turut 1, 87; 1,86 ; 1,42 ; 2,46 ; dan 2,22. Larutan yang mempunyai titik didih tertinggi adalah.. Kenaikan Titik Didih. Sifat Koligatif Larutan.

Melihat Proses Kenaikan Titik Didih Kimia Kelas 12 Belajar Gratis di Rumah Kapan Pun! Blog
Hidrogen sulfida, H 2 S, adalah gas yang tidak berwarna, beracun, mudah terbakar dan berbau seperti telur busuk. Gas ini dapat timbul dari aktivitas biologis ketika bakteri mengurai bahan organik dalam keadaan tanpa oksigen ( aktivitas anaerobik ), seperti di rawa, dan saluran pembuangan kotoran. Gas ini juga muncul pada gas yang timbul dari.

H2SO4 Lewis Structure, Molecular Geometry, and Hybridization Techiescientist
Titik didih: 290 °C Titik lebur: 10.4 °C pH: <1> Berat jenis: 1,84 Kepadatan uap: 3.38 BAGIAN 10 - STABILITAS DAN REAKTIFITAS Hindari kontak dengan basa kuat, bahan organik, logam bubuk halus, peroksida, karbonat, klorat, nitrat, dan zat pereduksi. Bereaksi hebat dengan air. Selalu tambahkan asam ke dalam air, jangan sebaliknya.
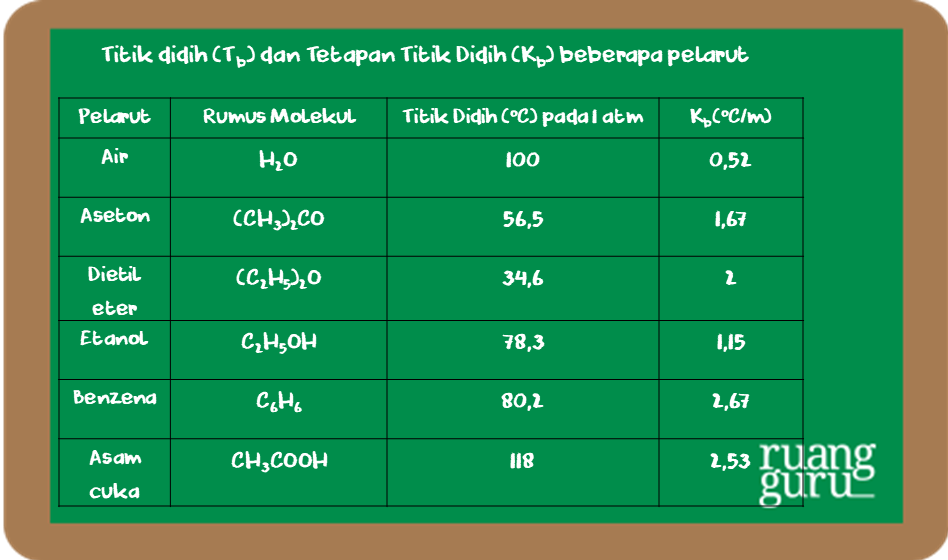
Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
Pada konsentrasi 98%, titik didih H2SO4 adalah sekitar 338 derajat Celsius, sedangkan titik beku dari asam sulfat berada pada suhu -10 derajat Celsius. Kelarutan. H2SO4 sangat larut dalam air, namun jika konsentrasinya sangat tinggi, maka proses pelarutan akan sangat lambat. Asam sulfat juga larut dalam pelarut organik seperti etanol, aseton.

Kenaikan Titik Didih Penurunan Titik Beku Sifat Koligatif Larutan Reverasite
Titik didih adalah suhu di mana tekanan uap suatu zat sama dengan tekanan atmosfer di sekitarnya. Titik didih dipengaruhi oleh faktor-faktor seperti konsentrasi, tekanan, dan ikatan antarmolekul. Artikel ini menjelaskan konsep titik didih secara ilmiah dan memberikan contoh-contoh titik didih beberapa senyawa kimia.

Perhatikan tabel data titik leleh dan titik didih beberap...
Nama produk : Asam sulfat c(H2SO4) = 1 mol/l (2 N) Titripur® Nomor Produk : 1.60313 No katalog : 160313 Merek : Millipore Nomor REACH : Produk ini adalah suatu preparasi. Nomor Registrasi REACH. Titik didih awal/rentang didih Data tidak tersedia f) Flamabilitas (padatan, gas) Data tidak tersedia g) Batas bawah/atas flamabilitas atau ledakan

hitunglah titik beku dan titik didih larutan H2SO4 0,2 m jika diketahui H2SO yang terurai =0,50
Titik cair: Informasi tidak tersedia Gravitasi yang digunakan 1.84 Titik Didih: Informasi tidak tersedia Persentase Penguapan: Informasi tidak tersedia Tekanan uap: 1mm Hg @ 145.8°C Tingkat Penguapan: <1 Kepadatan Uap: <0.3 @ 25°C Standar Penguapan: Kelarutan dalam Air: Dapat Larut Temperatur menyala otomatis: Tidak ada Bentuk dan bau: Cairan.
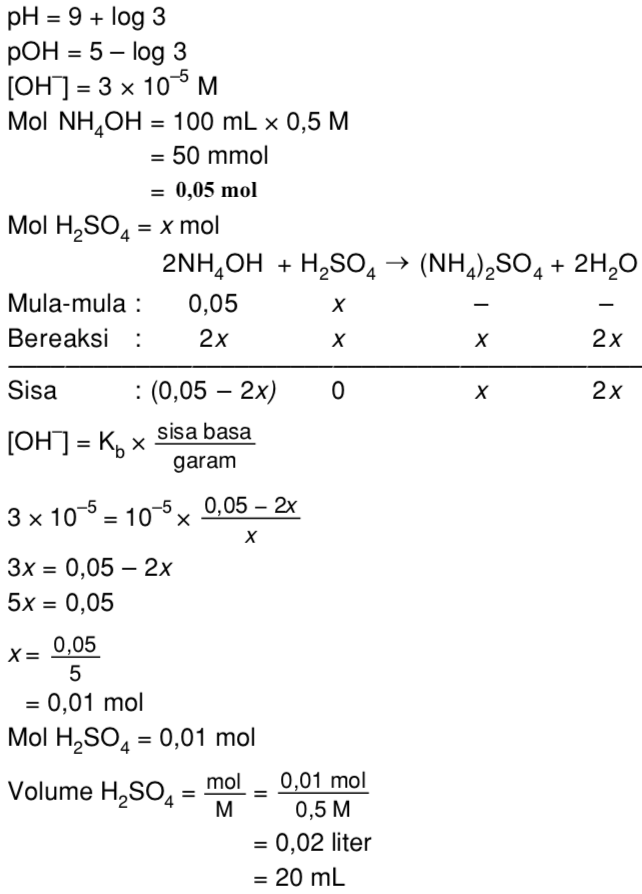
Berapa mL larutan H2SO4 0,5 M yang harus ditambahkan ke dalam 100 mL larutan NH4OH 0,5 M Mas Soal
Asam sulfat (H2SO4) merupakan asam mineral (anorganik) yang kuat yang mana ia berbentuk cairan yang bersifat korosif, tidak berwarna tidak berbau, sangat reaktif, dan mampu melarutkan berbagai logam. Bahan kimia ini dapat larut dengan air dengan segala perbandingan, mempunyai titik lebur 10,31°C dan titik didih pada 336,85°C tergantung.

H2SO4 Molecular Geometry / Shape and Bond Angles YouTube
Tb pelarut murni = titik didih pelarut (misal air : 100° C) ∆Tb = kenaikan titik didih. Sebuah larutan mempunyai titik didih yang lebih tinggi dibandingkan dengan titik didih pelarut murninya. Hal itu disebabkan karena larutan harus mencapai suhu di mana pelarut murni yang mendidih (misal air 100° C) juga harus melampaui titik didih zat.
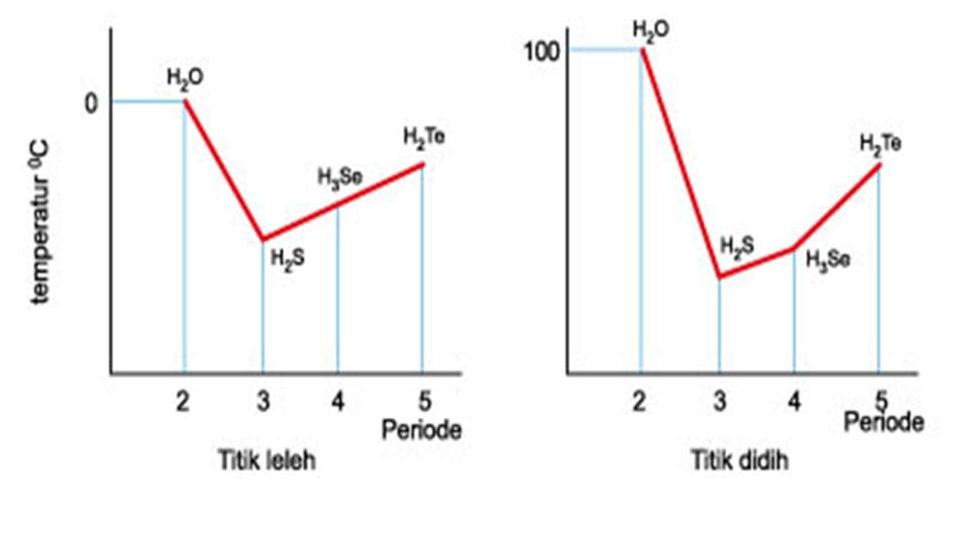
chemical engineering ikatan hidrogen
T b° = titik didih pelarut murni (air) T b = titik didih larutan. Kenaikan titik didih hanya tergantung pada jenis pelarut dan molaritas larutan, tidak tergantung pada jenis zat terlarut. Jika ditambahkan zat terlarut yang tidak mudah menguap, misalnya gula, maka dibutuhkan kenaikan titik didih yang cukup besar agar dapat mendidih.